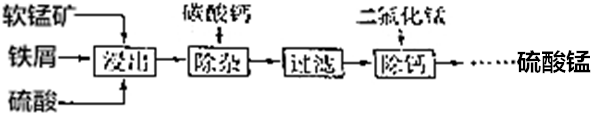
题目内容
17.把1L 0.1mol/L醋酸溶液用蒸馏水稀释到10L,下列叙述正确的是( )| A. | c(CH3COOH)变为原来的$\frac{1}{10}$ | B. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大 | ||
| C. | c(H+)变为原来的$\frac{1}{10}$ | D. | 溶液的导电性增强 |
分析 醋酸稀释,促进电离,氢离子浓度变小,pH变大,离子浓度越小,导电性越差,以此来解答.
解答 解:A.因醋酸为弱酸,稀释10倍,促进电离,则c(CH3COOH)小于原来的$\frac{1}{10}$,故A错误;
B.稀释10倍,促进电离,n(CH3COO-)增大,n(CH3COOH)减小,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{n(C{H}_{3}CO{O}^{-})}{n(C{H}_{3}COOH)}$的比值增大,故B正确;
C.稀释促进电离,n(H+)增大,所以c(H+)大于原来的$\frac{1}{10}$,故C错误;
D.稀释时,离子浓度变小,溶液的导电性减弱,故D错误;
故选B.
点评 本题考查弱电解质的稀释,明确稀释促进电离、电离程度增大而离子浓度减小即可解答,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
7.下列说法错误的是( )
| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 在共价化合物中一定含有共价键 |
8.下列各组仪器中可以用酒精灯直接加热的一组是( )
| A. | 试管、蒸发皿 | B. | 试管、烧杯 | C. | 试管、平底烧瓶 | D. | 蒸发皿、圆底烧瓶 |
5.化学让生活更美好,生活中涉及化学的点点滴滴.下列叙述正确的是( )
| A. | 用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾 | |
| B. | 小苏打可中和胃酸,热纯碱溶液可除油污;小苏打和纯碱可以用石灰水鉴别 | |
| C. | 用丁达尔效应区别鸡蛋白溶液和食盐水 | |
| D. | “84消毒液”和洁厕剂能同时使用,除污垢效果更好 |
2.下列各组物质中,按单质、化合物、混合物顺序排列的是( )
| A. | 稀有气体、浓硫酸、胆矾 | B. | 金刚石、石灰石、铁矿石 | ||
| C. | 天然气、碱式碳酸铜、液氧 | D. | 石墨、熟石灰、水煤气 |
7.下列热化学方程式正确的是(注:△H的绝对值均正确)( )
| A. | 2NO2═O2+2NO;△H=+116.2kJ/mol(反应热) | |
| B. | S(s)+O2(g)═SO2(g);△H=+269.8kJ/mol(反应热) | |
| C. | Ba(OH)2(aq)+2HCl(aq)═BaCl2(aq)+2H2O(l));△H=-57.3kJ/mol(中和热) | |
| D. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) |