题目内容
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | l L pH=l的硫酸溶液中含有的H+ 数为0.2NA | |
| C. | 78 g Na202固体中含有的阴离子数为2NA | |
| D. | 500 mL 2 mol.L-l FeCl2溶液中Fe3+数为NA,且$\frac{n(C{l}^{-})}{n(F{e}^{3+})}$=3 |
分析 A、石墨和C60均由碳原子构成;
B、pH=1的硫酸溶液中氢离子浓度为0.1mol/L;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根构成来分析;
D、FeCl2溶液中不含Fe3+.
解答 解:A、石墨和C60均由碳原子构成,故12g混合物中含有的碳原子的物质的量为n=$\frac{12g}{12g/mol}$=1mol,而碳原子中含6个质子,故1mol碳原子中含6mol质子即6NA个,故A正确;
B、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,故1L溶液中氢离子的物质的量为n=CV=0.1mol/L×1L=0.1mol,故含0.1NA个氢离子,故B错误;
C、78g过氧化钠的物质的量为n=$\frac{78g}{78g/mol}$=1mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根,故含NA个阴离子,故C错误;
D、FeCl2溶液中不含Fe3+,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
15.已知100mL某硫酸亚铁、硫酸、硫酸铁混合溶液中阳离子浓度相等,硫酸根离子总浓度为9mol/L,此溶液中还可溶解铁粉的质量为( )
| A. | 11.2g | B. | 16.8g | C. | 22.4g | D. | 33.5g |
16.下列离子方程式正确的是( )
| A. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| B. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
14.下列反应进行分类时(按初中的方法),既属于氧化反应又属于化合反应的是( )
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
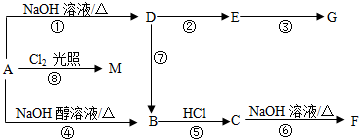
 有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:
有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验: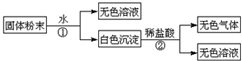

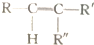 $\stackrel{高锰酸钾酸性溶液}{→}$R-COOH+
$\stackrel{高锰酸钾酸性溶液}{→}$R-COOH+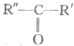
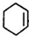 ,HOOC(CH2)4COOH.
,HOOC(CH2)4COOH.