题目内容
16.下列离子方程式正确的是( )| A. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| B. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
分析 A.碳酸氢根离子的酸性大于氢氧化铝,二者反应生成氢氧化铝沉淀和碳酸钠;
B.碳酸钠的溶解度大于碳酸氢钠,反应中会析出碳酸氢钠固体;
C.亚硫酸氢根离子不能拆开,应该保留整体形式;
D.硫酸根离子恰好沉淀时,硫酸铝铵与氢氧化钡的物质的量之比为1:2,铝离子与氢氧根离子按照1:3反应生成氢氧化铝沉淀后,铵根离子优先结合氢氧根离子,则氢氧化铝沉淀不会溶解.
解答 解:A.NaHCO3溶液中滴入偏铝酸钠溶液,反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32-,故A正确;
B.向饱和碳酸钠溶液中通入足量二氧化碳气体,会析出碳酸氢钠固体,正确的离子方程式为:2Na++CO32-+H2O+CO2=2NaHCO3↓,故B错误;
C.NaHSO3溶液与FeCl3溶液混合溶液颜色变浅,二者发生氧化还原反应,正确的离子方程式为:HSO3-+2Fe3++H2O═SO42-+2Fe2++3H+,故C错误;
D.向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全,由于铵根离子结合氢氧根离子能力大于氢氧化铝,则反应生成氢氧化铝沉淀和一水合氨,正确的离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故D错误;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;D为易错点,注意铵根离子结合氢氧根离子能力大于氢氧化铝.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
6.下列叙述正确的是( )
| A. | 使用磨口玻璃瓶、玻璃塞保存NaOH溶液 | |
| B. | 加入适量的金属钠除去酒精中少量的水 | |
| C. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝色的气体一定是Cl2 |
4.下列反应的离子方程式正确的是( )
| A. | NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 硫化钠的水解反应:S2-+2H2O?H2S+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-═Cu2++2NO↑+H2O |
11.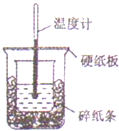 50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
 50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50ml0.5mol•L-1盐酸与50ml•L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )| A. | 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题 | |
| B. | 大烧杯上如不盖硬纸板,测得的中和热数值会偏大 | |
| C. | 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大 | |
| D. | 实验中改用60ml0.5mol•L-1盐酸跟50ml0.55mol•L-1NaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等 |
1.短周期主族元素A、B、C、D,原子序数依次增大.A、C原子序数相差8,A、B、C 三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | A元素与C元素形成的分子不可能是非极性分子 | |
| B. | A、C、D元素分别与氢元素形成的最简单氢化物中,D的氢化物沸点最高 | |
| C. | A、B、C、D四种元素的基态原子中,B的原子半径最大 | |
| D. | A、B、C、D 四种元素对应单质的晶体都是分子晶体 |
8.下列各组物质是按酸、碱、盐的顺序排列的是( )
| A. | 硫酸、纯碱、氯化钙 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、过氧化钠 |
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | l L pH=l的硫酸溶液中含有的H+ 数为0.2NA | |
| C. | 78 g Na202固体中含有的阴离子数为2NA | |
| D. | 500 mL 2 mol.L-l FeCl2溶液中Fe3+数为NA,且$\frac{n(C{l}^{-})}{n(F{e}^{3+})}$=3 |
6.用标准盐酸溶液滴定未知浓度的NaOH溶液,所测数据如下:
测得NaOH溶液的物质的量浓度为( )
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题: