题目内容
下列说法正确的是( )
| A、液氯能使干燥的有色布条褪色 |
| B、氯气与单质铁反应后,铁元素化合价变为+2价 |
| C、新制氯水呈黄绿色是因为其中存在氯气 |
| D、久置氯水遇AgNO3溶液不会产生白色沉淀 |
考点:氯气的化学性质
专题:卤族元素
分析:A.干燥的氯气不具有漂白性;
B.氯气与Fe反应生成氯化铁;
C.新制氯水中含氯气分子;
D.久置氯水中含氯离子.
B.氯气与Fe反应生成氯化铁;
C.新制氯水中含氯气分子;
D.久置氯水中含氯离子.
解答:
解:A.干燥的氯气不具有漂白性,则液氯不能使干燥的有色布条褪色,具有漂白性的物质为HClO,故A错误;
B.氯气与Fe反应生成氯化铁,则氯气与单质铁反应后,铁元素化合价变为+3价,故B错误;
C.新制氯水中含氯气分子,则新制氯水呈黄绿色,故C正确;
D.久置氯水中含氯离子,则久置氯水遇AgNO3溶液能产生白色沉淀,故D错误;
故选C.
B.氯气与Fe反应生成氯化铁,则氯气与单质铁反应后,铁元素化合价变为+3价,故B错误;
C.新制氯水中含氯气分子,则新制氯水呈黄绿色,故C正确;
D.久置氯水中含氯离子,则久置氯水遇AgNO3溶液能产生白色沉淀,故D错误;
故选C.
点评:本题考查氯气的化学性质,为高频考点,把握氯气的氧化性及氯水的成分、性质为解答的关键,注重基础知识的考查,注意液氯为单质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Na+、H+、CO32-、Cl- |
| B、H+、Fe2+、Cl-、NO3- |
| C、Na+、Al3+、OH-、Cl- |
| D、NH4+、H+、OH-、NO3- |
下列有关微粒半径大小的比较中,正确的是( )
| A、Na+>F- |
| B、Fe<Fe2+ |
| C、Cl<Cl- |
| D、K+<Ca2+ |
关于下列四个装置的说明符合实验要求的是( )


| A、装置①:实验室中若需制备较多量的乙炔可用此装置 |
| B、装置②:实验室中可用此装置来制备硝基苯,但产物中可能会混有苯磺酸 |
| C、装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘 |
| D、装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 |
下列元素中,原子半径最大的是( )
| A、O | B、F | C、P | D、Cl |
下列说法中,正确的是( )
| A、CO2的摩尔质量为44 g |
| B、1 mol N2的质量是14 g |
| C、等质量的水与质量分数98%L的硫酸混合所得溶液的质量分数大于49% |
| D、标准状况下,1 mol CO2所占的体积约是22.4 L |
 某有机物A的分子式为C10H20O2,已知A~E有如图转化关系.则A 的结构可能有( )
某有机物A的分子式为C10H20O2,已知A~E有如图转化关系.则A 的结构可能有( )| A、16种 | B、2种 | C、8种 | D、4种 |
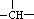 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)