题目内容
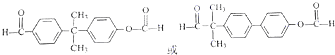
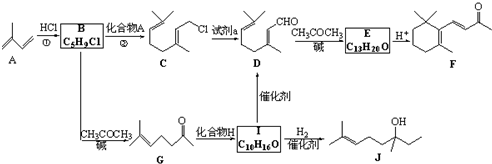
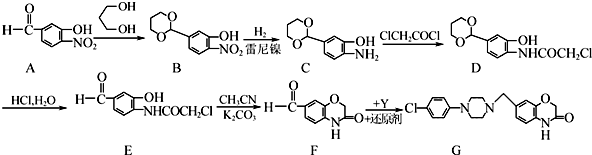
3.药物L-651896主要用于治疗骨缺损,可通过以下方法合成: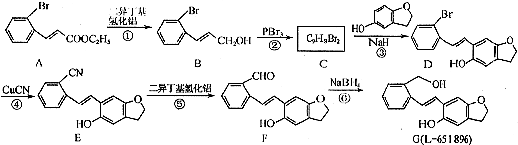
(1)D中含氧官能团为羟基和醚键(填官能团的名称).
(2)B→C的反应类型是取代反应;C的结构简式为
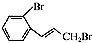 .
.(3)写出同时满足下列条件的G的一种同分异构体的结构简式:
 (只写一种).
(只写一种).Ⅰ.分子中含有2个苯环;Ⅱ.分子中含有7中不同化学环境的氢;
Ⅲ.能水解生成两种有机物,一种产物能发生银镜反应,另一种产物既能发生银镜反应又能与FeCl3溶液发生显色反应.
(4)请写出以
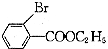 为原料制备二氢异苯并呋喃(结构简式如图
为原料制备二氢异苯并呋喃(结构简式如图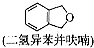 )的合成路线流程图(无机试剂可任选).
)的合成路线流程图(无机试剂可任选).
分析 (1)由D的结构简式,可知含有含氧官能团为羟基、醚键;
(2)对比B、C的分子式可知,B中-OH被-Br取代生成C;
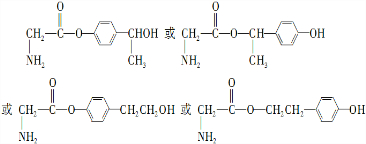
(3)G的一种同分异构体满足:Ⅰ.分子中含有2个苯环,Ⅱ.分子中含有7中不同化学环境的氢,Ⅲ.能水解生成两种有机物,说明含有酯基,一种产物能发生银镜反应,说明含有醛基,另一种产物既能发生银镜反应又能与FeCl3溶液发生显色反应,说明含有酚羟基,G的同分异构体含有醛基、羧酸与酚形成的酯基;
(4)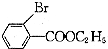 与CuCN反应得到
与CuCN反应得到 ,再与二异丁基氢化铝作用得到
,再与二异丁基氢化铝作用得到 ,然后与NaBH4作用得到
,然后与NaBH4作用得到 ,最后在浓硫酸作用下脱水生成
,最后在浓硫酸作用下脱水生成 .
.
解答 解:(1)由D的结构简式,可知含有含氧官能团为羟基、醚键,故答案为:羟基、醚键;
(2)对比B、C的分子式可知,B中-OH被-Br取代生成C,属于取代反应,C的结构简式为: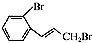 ,
,
故答案为:取代反应;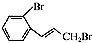 ;
;
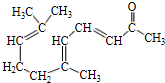
(3)G的一种同分异构体满足:Ⅰ.分子中含有2个苯环,Ⅱ.分子中含有7中不同化学环境的氢,Ⅲ.能水解生成两种有机物,说明含有酯基,一种产物能发生银镜反应,说明含有醛基,另一种产物既能发生银镜反应又能与FeCl3溶液发生显色反应,说明含有酚羟基,G的同分异构体含有醛基、羧酸与酚形成的酯基,符合条件的同分异构体为: ,
,
故答案为: ;
;
(4) 与CuCN反应得到
与CuCN反应得到 ,再与二异丁基氢化铝作用得到
,再与二异丁基氢化铝作用得到 ,然后与NaBH4作用得到
,然后与NaBH4作用得到 ,最后在浓硫酸作用下脱水生成
,最后在浓硫酸作用下脱水生成 ,合成路线流程图为:
,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的合成,侧重考查学生信息获取与迁移运用能力、分析推理能力,(3)中同分异构体的书写为易错点、难点.

练习册系列答案
相关题目
8.下列每小题最后的物质是要制取的,其中合理的是( )
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{蒸发}{→}$AlCl3 | |
| B. | Cu$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{冷却结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{NaOH}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3 | |
| D. | Mg$\stackrel{空气中燃烧}{→}$MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{蒸发}{→}$MgCl2 |
3.H2O2是实验室常用的一种化学试剂.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是_探究H2O2溶液的浓度的变化对分解速率的影响,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱
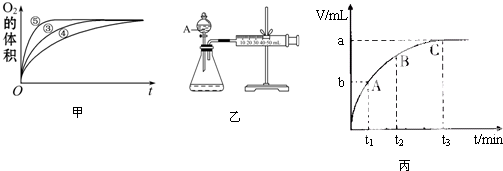
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱

(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
20.下列各组的电极材料和电解液,不能组成原电池的是( )
| A. | 铜片、银片,FeCl3溶液 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、石墨棒,稀硫酸 |
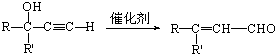 (R和R′表示烃基或氢)
(R和R′表示烃基或氢)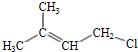 .
.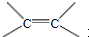 .
. .
. b.反应②的反应类型是加成反应
b.反应②的反应类型是加成反应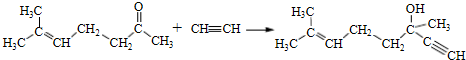 .
. .
.
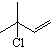
 的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原.
的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原. .
. .
.
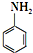 易氧化,酰胺基(
易氧化,酰胺基(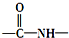 )难以被H2还原.
)难以被H2还原.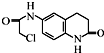 )是合成一种新型口服强心药的中间体,请写出以
)是合成一种新型口服强心药的中间体,请写出以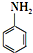 、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).
、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).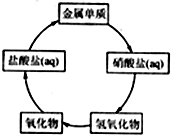 在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )
在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )