题目内容
19.已知A~K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性.一定条件下,各物质间的相互反应转化关系如图所示: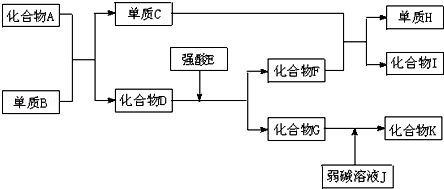
请回答:
(1)写出有关物质化学式:D是Al2O3,H是H2.
(2)写出下列反应的方程式:
①化合物G的溶液呈酸性 (酸性,碱性,中性),其原因用离子方程式表示为Al3++3H2O?Al(OH)3+3H+,
②写出C+F→H+I的化学方程式并用单线桥表示反应过程中电子转移的方向和数目
 .
.③G+J→K用离子方程式表示为Al3++3NH3•H2O=Al(OH)3+3NH4+.
分析 I是具有磁性的物质,应为Fe3O4,单质C与化合物F反应得到单质H与化合物I,由元素守恒可知C为Fe,D和K都具有两性,分别为氧化铝、氢氧化铝中的一种,单质B与化合物A反应得到Fe与D,该反应为铝热反应,可推知B为Al、A为Fe2O3、D为Al2O3,顺推可知F为H2O,G为AlCl3,H为H2,弱碱溶液J为氨水,K为Al(OH)3,据此解答.
解答 解:I是具有磁性的物质,应为Fe3O4,单质C与化合物F反应得到单质H与化合物I,由元素守恒可知C为Fe,D和K都具有两性,分别为氧化铝、氢氧化铝中的一种,单质B与化合物A反应得到Fe与D,该反应为铝热反应,可推知B为Al、A为Fe2O3、D为Al2O3,顺推可知F为H2O,G为AlCl3,H为H2,弱碱溶液J为氨水,K为Al(OH)3,
(1)由上述分析可知,D是Al2O3,H是H2,
故答案为:Al2O3;H2;
(2)①AlCl3溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,故答案为:酸性;Al3++3H2O?Al(OH)3+3H+;
②铁和水反应的化学方程式并用单线桥表示反应过程中电子转移的方向和数目 ,故答案为:
,故答案为: ;
;
③G为AlCl3,J为氨水,反应的离子方程式Al3++3NH3•H2O=Al(OH)3+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3+3NH4+.
点评 本题考查无机物推断,涉及Fe、Al元素化合物性质,“I是具有磁性的物质,D和K都具有两性”是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,题目难度中等.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 物质的摩尔质量等于该物质的相对分子质量 | |
| C. | O22-离子的摩尔质量是32 g•mol-1 | |
| D. | 1 mol H2O的质量为18 g•mol- |
14.下列问题的解决中,与化学有关的是( )
①治理污染 ②研究生命活动 ③防火防灾 ④消毒杀菌 ⑤制造新物质.
①治理污染 ②研究生命活动 ③防火防灾 ④消毒杀菌 ⑤制造新物质.
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有③④ | D. | 全部 |
11.每l00g草鱼中所含主要营养成分的平均质量为
则该草鱼能提供人类生命活动必需的营养素有( )
| 成分 | 糖类 | 蛋白质 | 油脂 | 水 | 维生素 | 钙 | 铁 | 锌 |
| 质量/g | 0 | 16.6 | 5.2 | 78.2 | 0.00004 | 0.038 | 0.0008 | 0.0009 |
| A. | 六大类 | B. | 五大类 | C. | 四大娄 | D. | 三大类 |
8.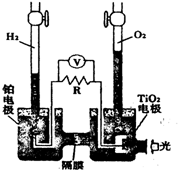 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将电能转化为化学能 | |
| B. | 铂电极上发生的反应为:2H++2e-=H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
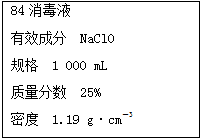 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
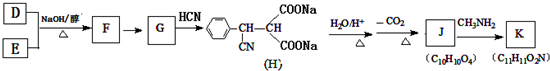
 ,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.
,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.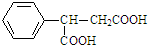 +CH3NH2$\stackrel{一定条件下}{→}$
+CH3NH2$\stackrel{一定条件下}{→}$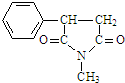 +2H2O.
+2H2O.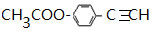 .
.