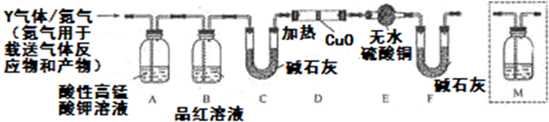
题目内容
7.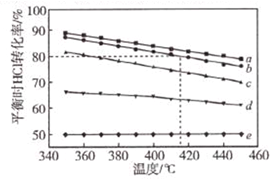 文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.请回答下列问题:
(1)可以判断该反应已经达到化学平衡的是BD. (填字母).
A.密闭容器中总压强不变
B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2)
D.密闭容器中氣气的体积分数不变
(2)d曲线对应的投料比是6:1(填比值,从题干中选择,下同).有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl):n(O2)=8:1制备.
(3)该反应的平衡常数表达式为$\frac{{c}^{2}(C{l}_{2}){c}^{2}({H}_{2}O)}{{c}^{4}(HCl)c({O}_{2})}$.
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为30.8%.
(5)用盐酸作甲醇燃料电池的电解质正在成为热点课题.甲醇可以用一氧化碳与氢气反应生成(催化剂为Cu2O/ZnO).
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-182.9kJ•mol-1
则 CO(g)+2H2(g)═CH3OH(g)△H=-100.1KJ/mol.
若将生成的CH3OH与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为CH3OH+H2O-6e-=CO2+6H+.
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)在其他条件不变时,O2的量越大,HCl的转化率越大;有机工业需要含O2量低的氧气和氯化氢混合气体,HCl转化率最小;
(3)反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(4)由图可读出投料比为2:1、温度为415℃时,HCl的转化率为80%,设投入的HCl为2 mol,O2为1 mol,由此可建立三段式:
4HCl+O2=2Cl2+2H2O
n(起始)/mol 2 1 0 0
n(转化)/mol 1.6 0.4 0.8 0.8
n(平恒)/mol 0.4 0.6 0.8 0.8
计算平衡混合气中Cl2的物质的量分数;
(5)依据热化学方程式和盖斯定律计算得到所需热化学方程式;若将生成的CH3OH与盐酸、氧气构成燃料电池,则燃料电池的负极反应为甲醇燃烧失电子生成二氧化碳;
解答 解:(1)4HCl(g)+O2(g)?2Cl2(g)+2H2O(g),反应是气体体积减小的反应,
A.气体物质的量发生变化,当密闭容器中总压强不变,说明反应达到平衡状态,故A正确;
B.气体质量不变,体积不变,密闭容器中混合气体的密度始终不变,故B错误;
C.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v(HCl)=2v(Cl2)不能说明正逆反应速率相同,不能说明反应达到平衡状态,故C错误;
D.密闭容器中氣气的体积分数不变是平衡标志,故D正确;
故答案为:BD;
(2)在其他条件不变时,O2的量越大,HCl的转化率越大,由此可确定a为1:1,b为2:1,c为4:1,d为6:1,e为8:1,有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl):n(O2)=8:1,
故答案为:6:1;8:1;
(3)4HCl(g)+O2(g)?2Cl2(g)+2H2O(g),反应的平衡常数K=$\frac{{c}^{2}(C{l}_{2}){c}^{2}({H}_{2}O)}{{c}^{4}(HCl)c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(C{l}_{2}){c}^{2}({H}_{2}O)}{{c}^{4}(HCl)c({O}_{2})}$;
(4)由图可读出投料比为2:1、温度为415℃时,HCl的转化率为80%,设投入的HCl为2 mol,O2为1 mol,由此可建立三段式:
4HCl+O2=2Cl2+2H2O
n(起始)/mol 2 1 0 0
n(转化)/mol 1.6 0.4 0.8 0.8
n(平恒)/mol 0.4 0.6 0.8 0.8
计算平衡混合气中Cl2的物质的量分数=$\frac{0.8mol}{0.4mol+0.6mol+0.8mol+0.8mol}$×100%=30.8%,
故答案为:30.8%;
(5)①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-182.9kJ•mol-1
则 依据盖斯定律计算(①-②×2)×$\frac{1}{2}$得到热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-100.1KJ/mol,
若将生成的CH3OH与盐酸、氧气构成燃料电池,则燃料电池的负极反应为甲醇燃烧失电子生成二氧化碳;负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,
故答案为:-100.1KJ/mol;CH3OH+H2O-6e-=CO2+6H+;
点评 本题考查了化学平衡标志判断、图象变化分析、转化率的理解应用、平衡常数计算、热化学方程式书写、原电池原理等知识点,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | CHl0?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++HPO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是H3PO4(填化学式,下同),最弱的是HPO42-.
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O═HClO+HCO3-,1.2mol•L-1的NaClO溶液pH=10.8(已知:lg2=0.3).
(3)求出该温度下,0.10mol•L-1的CH3COOH溶液中的c(H+)=1.4×10-3mol•L-1.
| A. | 使用时电池负极区溶液的碱性增强 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极 | |
| C. | 溶液中OH-离子由正极向负极移动 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| A. | 1 mol Na2O2和水完全反应,转移电子数为2NA | |
| B. | 0.5 L 0.2 mol•L-1 FeCl3溶液中,含Fe3+数为0.1NA | |
| C. | 在一定条件下,催化分解80 g SO3,混合气体中氧原子数为3NA | |
| D. | 常温常压下,28 g乙烯和丙烯混合气体含有的碳原子总数为2.5NA |
| A. | 1 mol H2O所含电子数为10NA | |
| B. | 1 mol Al与足量的稀盐酸溶液反应生成氢气1.5 mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2 L | |
| D. | 在非标准状况下,22.4 L O2含有的分子数一定不是NA |
| A. | 羧基的电子式: | B. | F-的结构示意图: | ||
| C. | 四氯化碳的比例模型: | D. | HClO的结构式:H-Cl-O |
| A. | 用饱和碳酸钠溶液洗 | B. | 用盐酸洗 | ||
| C. | 用氢氧化钠溶液洗 | D. | 用水洗 |