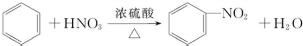
题目内容
2.设阿伏加德罗常数的数值为NA,下列说法正确的是( )| A. | 1 mol Na2O2和水完全反应,转移电子数为2NA | |
| B. | 0.5 L 0.2 mol•L-1 FeCl3溶液中,含Fe3+数为0.1NA | |
| C. | 在一定条件下,催化分解80 g SO3,混合气体中氧原子数为3NA | |
| D. | 常温常压下,28 g乙烯和丙烯混合气体含有的碳原子总数为2.5NA |
分析 A、过氧化钠和水的反应为歧化反应;
B、铁离子为弱碱阳离子,在溶液中会水解;
C、求出三氧化硫的物质的量,然后根据其分解过程中氧原子个数守恒来分析;
D、乙烯和丙烯的最简式均为CH2.
解答 解:A、过氧化钠和水的反应为歧化反应,1mol过氧化钠转移NA个电子,故B错误;
B、铁离子为弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于0.1NA个,故B错误;
C、80g三氧化硫的物质的量为1mol,含3mol氧原子,而其分解过程中氧原子个数守恒,故其分解后的混合物中含有的氧原子个数仍为3NA个,故C正确;
D、乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量为2mol,则含2NA个碳原子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
13.在下列各溶液中,离子一定能大量共存的是( )
| A. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、SiO32-、SO42- |
17.常温下,下列溶液中各组离子一定大量共存的是( )
| A. | 使pH试纸呈红色的溶液中:Na+、AlO2-、NO3-、CO32- | |
| B. | 遇苯酚溶液显紫色的溶液:Na+、SO32-、S2-、Cl- | |
| C. | 含有0.1 mol•L-1 HCO3-的溶液:Na+、K+、NO3-、C6H5O- | |
| D. | 水电离出的H+浓度为1.0×10-12 mol•L-1的溶液:Na+、Fe3+、SO42-、NO3- |
14.血液可看成一种胶体.某些严重肾病患者需要定期做血液透析,以除去其血液中积累过多的离子,同时向血液中补充人体需要的化学成分.血液透析仪器中,最为关键的器件是透析膜,你认为透析膜的孔径大约应该为( )
| A. | 0.1 nm左右 | B. | 50 nm左右 | C. | 0.001 mm左右 | D. | 100 mm左右 |
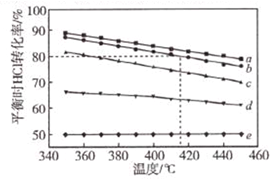 文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.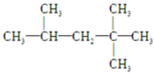 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为
;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为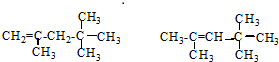 .
. 下列给出了烃及烃的衍生物A、B、C、D、E的相关信息:
下列给出了烃及烃的衍生物A、B、C、D、E的相关信息: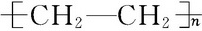 .
.