题目内容
15.微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-根据上述反应式,判断下列叙述中正确的是( )| A. | 使用时电池负极区溶液的碱性增强 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极 | |
| C. | 溶液中OH-离子由正极向负极移动 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
分析 银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH-,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,以此来解答.
解答 解:A.负极发生Zn+2OH--2e=ZnO+H2O,c(OH-)减小,所以电池负极区溶液的碱性减弱,故A错误;
B.Zn为负极,Ag2O为正极,电流由正极经外电路流向负极,而电子由负极流向正极,即Zn极流向Ag2O极,故B错误;
C.原电池中阴离子向负极移动,溶液中OH-离子由正极向负极移动,故C正确;
D.Zn电极发生氧化反应,Ag2O电极发生还原反应,故D错误.
故选C.
点评 本题考查原电池的工作原理,为高频考点,侧重学生的分析能力的考查,明确电极反应、正负极的判断、电子的流向即可解答,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
6.在标准状况下,15L由NO2、N2、和NH3,三种气体组成的混合气体,通过稀HNO3后,酸液质量增加15.9g,气体体积缩小为3.80L,则混合气中NO2、N2、和NH3体的体积(单位:L)分别为( )
| A. | 6.72、1.56、6.72 | B. | 4.62、5.6、3.78 | C. | 6、8、7 | D. | 6.72、6.72、1.56 |
3.下列物质按氧化物、酸、碱、盐的顺序排列正确的是( )
| A. | MgO、H2SO4、Na2O、CaCl2 | B. | MnO2、HNO3、KOH、K2CO3 | ||
| C. | SO2、NaHSO4、Ca(OH)2、KCl | D. | H2O、HCl、纯碱(Na2CO3)、盐酸 |
4.欲鉴别浓度均为1mol/L的KCl、(NH4)2SO4、NH3•H2O、H2SO4四瓶无色溶液,下列各实验方案最佳的是( )
| A. | 用pH试纸测试 | B. | 用闻气味和pH试纸测试 | ||
| C. | 用Ba(OH)2溶液和酚酞试液 | D. | 用NaOH和BaCl2溶液鉴别 |


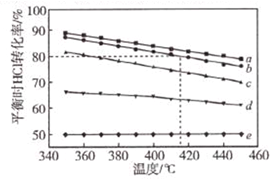 文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g).将HC1和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化氯影响的曲线如图.