题目内容
10.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的.爆炸的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑.该反应中,KNO3被还原(填“被氧化”或“被还原”),C是还原剂(填“氧化剂”或“还原剂”);得到1mol的N2需要消耗36g 的碳单质.分析 该反应中,硫元素化合价由0价变为-2价,N元素化合价由+5价变为0价,碳元素化合价由0价变为+4价,根据元素化合价变化判断氧化剂和还原剂,氧化剂在反应中被还原,还原剂在反应中被氧化,以此解答.
解答 解:反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到-2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,被还原,C元素化合价由0价升高到+4价,则C为还原剂,由方程式可知,得到1mol的N2需要消耗3molC,即36g,
故答案为:被还原;还原剂;36.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
11.25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1NaHSO3溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1NaHSO3溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
1.有七种物质:①甲烷、②苯、③聚乙炔、④聚异戊二烯、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ③⑤⑦ | D. | ③④⑤⑦ |
18.下列物质不是混合物的是( )
| A. | 水玻璃 | B. | 漂白粉 | C. | 冰水 | D. | 氯水 |
2.25℃时,由水电离出c(OH-)=1×10-11mol/L 的溶液中,一定能大量共存的离子组是( )
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、CH3COO-、K+、CO32- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、NO3-、Cl-、Na+ |

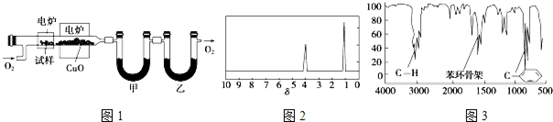
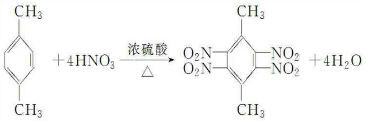 .
.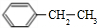 、
、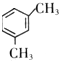 .
.