题目内容
符合下列某一个选项的反应一定可以自发进行,这个选项是( )
| A、吸热的熵增反应 |
| B、放热的熵增反应 |
| C、放热的熵减反应 |
| D、吸热的熵减反应 |
考点:焓变和熵变
专题:化学反应中的能量变化
分析:化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T?△S<0时,反应能自发进行,当△G=△H-T?△S>0时,反应不能自发进行,据此分析.
解答:
解:A.吸热的熵增反应,△H>0,△S>0,△H-T?△S能否小于0,取决于反应的温度,故A错误;
B.放热的熵增反应,△H<0,△S>0,△H-T?△S一定小于0,故B正确;
C.放热的熵减反应,△H<0,△S<0,△H-T?△S能否小于0,取决于反应的温度,故C错误;
D.吸热的熵减反应,△H>0,△S<0,△H-T?△S一定大于0,反应一定不能自发进行,故D错误;
故选:B.
B.放热的熵增反应,△H<0,△S>0,△H-T?△S一定小于0,故B正确;
C.放热的熵减反应,△H<0,△S<0,△H-T?△S能否小于0,取决于反应的温度,故C错误;
D.吸热的熵减反应,△H>0,△S<0,△H-T?△S一定大于0,反应一定不能自发进行,故D错误;
故选:B.
点评:本题考查熵变与焓变,注意根据自由能判据△G=△H-T?△S判断反应的自发性,题目难度不大.

练习册系列答案
相关题目
在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4溶液;电源有a、b两极.若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,实验现象如图所示,下列说法正确的是( )


| A、电源中a为正极,b为负极 |
| B、试管A中的电极反应式为:2H++2e-=H2↑ |
| C、一段时间后滤纸条上紫红色向C处移动 |
| D、电解一段时间后,切断K2、K3,闭合K1,电流计的指针会发生偏转 |
在溶液中能大量共存,加入OH-有沉淀析出,加入H+有气体放出的是( )
| A、Na+、Cu2+、Cl-、SO42- |
| B、Na+、Ca2+、Cl-、HCO3- |
| C、H+、Al3+、OH-、NO3- |
| D、Fe3+、K+、SO42-、NO3- |
已知反应:
①Cl2+2KBr=2KCl+Br2,
②KClO3+6HCl=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3,
下列说法正确的是( )
①Cl2+2KBr=2KCl+Br2,
②KClO3+6HCl=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3,
下列说法正确的是( )
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、反应③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
| C、反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D、氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
关于强、弱电解质的叙述不正确的是( )
| A、强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| B、同一弱电解质溶液,温度不同时,导电能力不同 |
| C、强电解质在溶液中完全电离,但溶液中存在电离平衡 |
| D、强电解质在固态或液态时,可能不导电 |
下列说法或表示方法正确的是( )
| A、若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由“C(石墨)═C(金刚石)△H=1.9 kJ?mol”可知,金刚石比石墨稳定 |
| C、在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
| D、在稀溶液中:H++OH-═H2O△H=-57.3 kJ?mol,若将含1mol H2SO4与含2mol NaOH的溶液混合,放出的热量等于114.6 kJ |
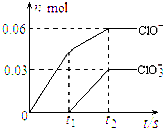 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量是16.8g |
| D、氯气被还原成0.06molClO-和0.03molClO3- |