题目内容
如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲可作发酵粉,乙是一种常用的化肥.B、D常温下是气体.请回答下列问题:
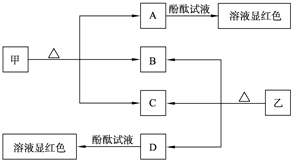
(1)甲的俗名是 .
(2)A的水溶液滴入酚酞试液显红色,用相关的离子方程式解释:
(3)甲溶液中加入氯化铝溶液,可以观察到的现象为 ,试写出反应的离子方程式: .

(1)甲的俗名是
(2)A的水溶液滴入酚酞试液显红色,用相关的离子方程式解释:
(3)甲溶液中加入氯化铝溶液,可以观察到的现象为
考点:无机物的推断
专题:推断题
分析:甲是发酵粉的主要成分,且阴、阳离子个数比为1:1,应为NaHCO3,则A为Na2CO3,乙是一种常用的化肥,由图中转化关系可知应为NH4HCO3,则B为CO2,D为NH3,C为H2O,以此解答该题.
解答:
解:甲是发酵粉的主要成分,且阴、阳离子个数比为1:1,应为NaHCO3,则A为Na2CO3,乙是一种常用的化肥,由图中转化关系可知应为NH4HCO3,则B为CO2,D为NH3,C为H2O,
(1)由以上分析可知甲为NaHCO3,俗名小苏打,故答案为:小苏打;
(2)A为Na2CO3,水解显碱性,离子反应为CO32-+H2O HCO3-+OH-,所以加入酚酞后溶液显红色,故答案为:CO32-+H2O
HCO3-+OH-,所以加入酚酞后溶液显红色,故答案为:CO32-+H2O HCO3-+OH-;
HCO3-+OH-;
(3)甲为NaHCO3,和与氯化铝发生互促水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为3HCO3-+Al3+=Al(OH)3↓+3CO2↑,
故答案为:有白色沉淀生成同时有大量气泡产生;3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
(1)由以上分析可知甲为NaHCO3,俗名小苏打,故答案为:小苏打;
(2)A为Na2CO3,水解显碱性,离子反应为CO32-+H2O
 HCO3-+OH-,所以加入酚酞后溶液显红色,故答案为:CO32-+H2O
HCO3-+OH-,所以加入酚酞后溶液显红色,故答案为:CO32-+H2O HCO3-+OH-;
HCO3-+OH-;(3)甲为NaHCO3,和与氯化铝发生互促水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为3HCO3-+Al3+=Al(OH)3↓+3CO2↑,
故答案为:有白色沉淀生成同时有大量气泡产生;3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
点评:本题考查无机物的推断,题目难度不大,注意常见物质的用途,为解答该题的关键,解答本题还要牢固把握常见物质的性质,本题涉及侯氏制碱法的制备原理.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
下列实验操作中,错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、用100 mL容量瓶配制90mL1mol/L的NaOH溶液 |
| C、用pH试纸测得新制氯水的pH为2 |
| D、用酸式滴定管准确量取10.00mLKMnO4溶液 |
取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到固体X和滤液Y.下列叙述正确的是( )
| A、上述四种氧化物对应的水化物中,至少有三种是碱性氧化物 |
| B、将固体X加入氢氟酸中,X会溶解 |
| C、滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种 |
| D、滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
下列关于过氧化钠的叙述正确的是( )
| A、过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 |
| B、可用Na2O2除去N2中的水蒸气 |
| C、过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂 |
| D、过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
 将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:
将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:



 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.