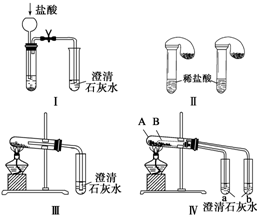
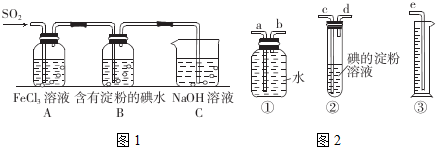
题目内容
2.目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2Na.现有如下转化关系(其他产物和水已略去):
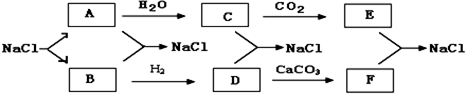
(1)写出A、D、F的化学式.
ANa;DHCl;FCaCl2;
(2)写出下列化学方程式:
C+D→NaClHCl+NaOH=NaCl+H2O;
E+F→NaClNa2CO3+CaCl2=CaCO3↓+2NaCl.
分析 根据各物质转化关系,电解融熔的氯化钠生成氯气和钠,其中B能与氢气反应,所以B为Cl2,则A为Na,氯气与氢气反应生成D为HCl,盐酸与碳酸钙反应生成F为CaCl2,Na与水反应生成C为NaOH,C与二氧化碳反应生成E为Na2CO3,氢氧化钠与盐酸、碳酸钠与氯化钙都能生成氯化钠,符合各物质的转化关系,据此解答.
解答 解:根据各物质转化关系,电解融熔的氯化钠生成氯气和钠,其中B能与氢气反应,所以B为Cl2,则A为Na,氯气与氢气反应生成D为HCl,盐酸与碳酸钙反应生成F为CaCl2,Na与水反应生成C为NaOH,C与二氧化碳反应生成E为Na2CO3,氢氧化钠与盐酸、碳酸钠与氯化钙都能生成氯化钠,符合各物质的转化关系,
(1)根据上面的分析可知,A为Na,D为HCl,F为CaCl2,
故答案为:Na;HCl;CaCl2;
(2)C+D→NaCl的反应方程式为HCl+NaOH=NaCl+H2O,E+F→NaCl的反应方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl,
故答案为:HCl+NaOH=NaCl+H2O;Na2CO3+CaCl2=CaCO3↓+2NaCl.
点评 本题考查无机物的推断,为高频考点,把握钠及其化合物的性质、氯气的性质是解答本题的关键,注意物质之间的转化即可解答,题目难度不大.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
13.下列现象或应用不能用胶体知识解释的是( )
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
7.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子数目是0.4NA | |
| C. | 1mol Cl2,与H2O反应转移NA个电子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
14.已知:△G=△H-T△S,△H为焓变,T为热力学温度,△S熵变,当△G<0时反应能自发进行,△G>0时反应不能自发进行,据此,下列吸热反应中,在高温下不能自发进行的是( )
| A. | CO(g)═C(s)+$\frac{1}{2}$O2(g) | B. | 2N2O5(g)═4NO2(g)+O2(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |