题目内容
7.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )| A. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子数目是0.4NA | |
| C. | 1mol Cl2,与H2O反应转移NA个电子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
分析 A、Na与足量O2反应,生成Na2O2;
B、过氧化钠与水的反应中,氧元素由-1价变为0价;
C、氯气和水的反应为歧化反应;
D、铁反应生成四氧化三铁后,铁的价态变为+$\frac{8}{3}$.
解答 解:A、Na与足量O2反应,生成Na2O2,而不是Na2O和Na2O2的混合物,故A错误;
B、过氧化钠与水的反应中,氧元素由-1价变为0价,故当生成0.2mol氧气时转移0.4mol电子即0.4NA个,故B正确;
C、氯气和水的反应为歧化反应,故1mol氯气转移1mol电子即NA个,故C正确;
D、铁反应生成四氧化三铁后,铁的价态变为+$\frac{8}{3}$,故3mol铁反应后转移8mol电子即8NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
17.下列设计的实验方案能达到实验目的是( )
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1 FeCl3溶液中加入0.1 mol•L-1KI溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
12.纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
①据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是液态;分离二者所采取的操作名称是蒸馏.
②Ⅲ中反应的化学方程式是TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在坩埚(填字母序号图 1)中加热.
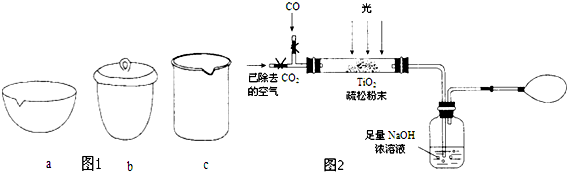
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为25%.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
②Ⅲ中反应的化学方程式是TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在坩埚(填字母序号图 1)中加热.

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为25%.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
16.在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③3.4gNH3.下列对这三种气体的相关量的关系比较不正确的是( )
| A. | 质量:②>①>③ | B. | 氢原子数:②>①>③ | C. | 体积:②>①>③ | D. | 密度:②>③>① |
 ;
;

 .
.