题目内容
6.焦亚硫酸钠(Na2S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中.(1)Na2S2O5中硫元素的化合价是+4,焦亚硫酸钠在空气中久置会与氧气反应生成连二硫酸钠(Na2S2O6),写出该反应的化学方程式,并标出该反应电子的转移方向和数目
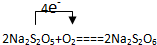 ;
;(2)葡萄酒中的Na2S2O5的使用量是以游离的SO2来计算的,SO2的摩尔质量64g/mol.我国规定每升葡萄酒中SO2的最高含量是0.25g,则一瓶800mL的葡萄酒中SO2的物质的量不能超过0.003mol(精确到0.001 );
(3)世界卫生组织规定按照体重计算,每人每天摄入SO2的最大量应控制在0.7mg/kg,如果一个人体重是60kg,那么他每天喝上述葡萄酒的量不超过168mL就不会造成健康上的问题.
分析 (1)根据化合价代数和为0,分析硫元素的化合价;焦亚硫酸钠在空气中久置会与氧气反应生成连二硫酸钠(Na2S2O6),反应方程式为:2Na2S2O5+O2=2Na2S2O6,根据得失电子守恒标出电子的转移方向;
(2)SO2的摩尔质量64g/mol;我国规定每升葡萄酒中SO2的最高含量是0.25g,则一瓶800mL的葡萄酒中SO2的物质的量不能超过$\frac{800}{1000}×0.25g$=0.2g,根据n=$\frac{m}{M}$进行计算求解;
(3)这个人每天摄入SO2的最大量为0.7mg/kg×60kg=42mg,所以他每天喝上述葡萄酒的量不超过$\frac{42mg}{0.25mg/ml}$=168ml.
解答 解:(1)设Na2S2O5中硫元素的化合价为+x价,则2+2x=2×5,解之得x=4,所以硫元素的化合价为+4价,),反应方程式为:2Na2S2O5+O2=2Na2S2O6,硫元素的化合价升高,氧元素的化合价降低,所以电子转移为: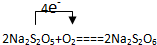 ,故答案为:+4;
,故答案为:+4;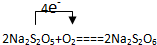 ;
;
(2)SO2的摩尔质量64g/mol;我国规定每升葡萄酒中SO2的最高含量是0.25g,则一瓶800mL的葡萄酒中SO2的物质的量不能超过$\frac{800}{1000}×0.25g$=0.2g,根据n=$\frac{m}{M}$=$\frac{0.2g}{64g/mol}$=0.003mol,故答案为:64g/mol;0.003mol;
(3)这个人每天摄入SO2的最大量为0.7mg/kg×60kg=42mg,所以他每天喝上述葡萄酒的量不超过$\frac{42mg}{0.25mg/ml}$=168ml,故答案为:168mL.
点评 本题题考查物质的量浓度的有关计算,题目难度不大,对标签中浓度的理解是关键,注意公式的灵活运用.

 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | 氧气的摩尔质量是32 g | |
| B. | 6.02×1023个N2分子的质量是28 g/mol | |
| C. | 1 mol H2O的质量是18g | |
| D. | 1 mol CO2中所含氧原子数约是6.02×1023个 |
| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 | |
| B. | 元素的种类由质子数决定,核素的种类由质量数决定 | |
| C. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| D. | 新制氯水应保存在无色试剂瓶中 |
| A. | 核聚变是化学变化 | |
| B. | 32He和42He互为同位素 | |
| C. | 32He原子核内含有3个中子 | |
| D. | 42He的最外层电子数为2,所以42He具有较强的金属性 |
| A. | 5.55g | B. | 7.55g | C. | 11.1g | D. | 无 |
| A. | 稀硫酸 | B. | 盐酸溶液 | C. | 稀硝酸 | D. | 氢氧化钠溶液 |