题目内容
下列反应的离子方程式书写正确的是( )
| A、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |
| B、碳酸钙与稀盐酸的反应:CO32-+2H+=CO2+H2O |
| C、氨水与盐酸反应:OH-+H+=H2O |
| D、实验室用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
考点:离子方程式的书写
专题:
分析:A.电子、电荷不守恒;
B.碳酸钙在离子反应中保留化学式;
C.一水合氨在离子反应中保留化学式;
D.氯气与NaOH反应生成氯化钠、次氯酸钠.
B.碳酸钙在离子反应中保留化学式;
C.一水合氨在离子反应中保留化学式;
D.氯气与NaOH反应生成氯化钠、次氯酸钠.
解答:
解:A.铝与稀硫酸反应的离子反应为2Al+6H+=2Al3++3H2↑,故A错误;
B.碳酸钙与稀盐酸的反应的离子反应为CaCO3+2H+=CO2+H2O+Ca2+,故B错误;
C.氨水与盐酸反应的离子反应为NH3.H2O+H+=H2O+NH4+,故C错误;
D.实验室用氢氧化钠溶液吸收多余的Cl2的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故D正确;
故选D.
B.碳酸钙与稀盐酸的反应的离子反应为CaCO3+2H+=CO2+H2O+Ca2+,故B错误;
C.氨水与盐酸反应的离子反应为NH3.H2O+H+=H2O+NH4+,故C错误;
D.实验室用氢氧化钠溶液吸收多余的Cl2的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故D正确;
故选D.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的考查,题目难度不大.

练习册系列答案
相关题目
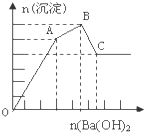 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( ) | 氢氧化物 | 溶液PH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)2 | 2.3 | 3.4 | - | - |
| Al(OH)2 | 3.3 | 5.2 | 7.8 | 12.8 |
| A、C点的沉淀为:Fe(OH)3和 BaSO4 |
| B、OA段可能发生的反应有:3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| C、AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-→2BaSO4↓+Al(OH)3↓ |
| D、据图计算原溶液中c(Cl-)=c(SO42-) |
第ⅠA族元素具有相似的化学性质,是由于它们的原子具有相同的( )
| A、原子半径 | B、电子层数 |
| C、核外电子数 | D、最外层电子数 |
对于分子 中手性碳的位置在碳原子上的组合准确的是(
中手性碳的位置在碳原子上的组合准确的是(
 中手性碳的位置在碳原子上的组合准确的是(
中手性碳的位置在碳原子上的组合准确的是(| A、①②③ | B、②④⑦ |
| C、④⑤⑥ | D、②④⑥ |
下列说法错误的是( )
| A、0.1 mol?L-1的CH3COOH溶液中,由水电离的[H+]为10-13mol?L-1 |
| B、pH=2与pH=1的CH3COOH溶液中[H+]之比为1:10 |
| C、pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合,混合后溶液pH<7 |
| D、1 mol醋酸分子中含有共价键的个数为8NA |
金属钠着火时,可以灭火的物质是( )
| A、湿布 |
| B、干粉灭火器(主要成分:CO2) |
| C、煤油 |
| D、沙子 |
下列有机反应方程式书写正确的是( )
A、CH3COOH+CH3CH2OH
| |||
B、CH4+Cl2
| |||
C、2CH3CH2OH+O2
| |||
D、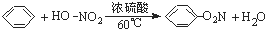 |
 有A、B、C、D四种物质的溶液,在进行焰色反应实验时,火焰都呈黄色,它们之间可发生如图所示的转化,则这四种物质分别为:
有A、B、C、D四种物质的溶液,在进行焰色反应实验时,火焰都呈黄色,它们之间可发生如图所示的转化,则这四种物质分别为: