题目内容
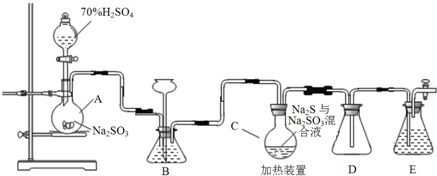
14.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.(c装置中盛装Na2S和Na2SO3)烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变,则整个装置气密性良好.装置D的作用是防止倒吸.装置E中为NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择d.
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度;已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或混浊消失).反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有ad.
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质.
已知Na2S2O3•5H2O遇酸易分解:S2O32-+2H+═S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
分析 A装置用于制取二氧化硫,装置B的作用之一是观察SO2的生成速率,装置B中液体不能和二氧化硫反应;C中Na2S、Na2SO3混合发生反应Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)、2H2S(aq)+SO2(g)═3S(s)+2H2O(l)、S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)生成Na2S2O3,D装置有缓冲作用,能防止E发生倒吸;E用于吸收尾气;
(1)利用压强差检验装置气密性;有缓冲作用的装置能防止倒吸;二氧化硫、硫化氢都能污染空气,不能直接排空,应该用碱液处理;
(2)根据题中所给3个反应可得出:2Na2S~2H2S~3S~3Na2SO3,根据关系式计算;
(3)装置B的作用之一是观察SO2的生成速率,其中的液体不能和二氧化硫反应;
二氧化硫进入C装置的速率与硫酸的流速成正比;
S难溶于水,可以根据溶液是否浑浊判断烧瓶C中反应是否达到终点;
反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有烧杯和锥形瓶;
(4)Na2S2O3和Na2SO3都能与酸反应生成S沉淀或SO2,而Na2SO4与酸不反应,用盐酸酸化的氯化钡溶液检验硫酸根离子,如果产生白色沉淀就说明含有硫酸钠.
解答 解:(1)利用装置内外气压差来检验装置的气密性,若液注高度保持不变,说明气密性良好;D为安全瓶,有缓冲作用,能防止倒吸;装置E用来吸收尾气中SO2和H2S,二者均为酸性气体,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)根据题中所给3个反应可得出:2Na2S~2H2S~3S~3Na2SO3,若C中有2molNa2S,其反应生成2molH2S的同时生成2molNa2SO3,则C中只需要1molNa2SO3即可,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,故答案为:2:1;
(3)a.SO2易溶于水,不能用蒸馏水,故错误;
b.SO2能与Na2SO3反应生成NaHSO3,不能用饱和Na2SO3溶液,故错误;
c.SO2能与NaHCO3反应生成Na2SO3和CO2,不能用饱和NaHSO3溶液,故错误;
d.SO2在饱和NaHSO3溶液中溶解度较小,可以选用,故正确;
故选d;
为使SO2缓慢进入烧瓶C,可通过控制滴加硫酸的速度达到实验目的;反应III 中反应物为不溶于水的单质硫,当烧瓶C中反应达到终点时,固体硫完全反应,则溶液变澄清(或浑浊消失);蒸发皿和试管可以直接加热,烧杯和锥形瓶加热时需要使用石棉网,故选a、d;
故答案为:d;控制滴加硫酸的速度;溶液变澄清(或混浊消失);ad;
(4)根据已知条件,Na2S2O3和Na2SO3都能与酸反应生成S沉淀或SO2,而Na2SO4与酸不反应,则检测Na2SO4的操作为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质.
点评 本题考查实验基本操作、实验方案的设计与评价、物质的检验等,侧重考查学生实验操作能力、评价能力及综合知识运用能力,注意硫酸根离子检验时化学用语的正确运用,要体现“操作、现象、结论”方可得到满分,很多同学往往漏掉结论而导致失分,题目难度不大.

①在滤液中通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤.
合理的操作顺序是( )
| A. | ②⑤①③④ | B. | ①③⑤②④ | C. | ①②③④⑤ | D. | ②①③⑤④ |
①试管②泥三角③蒸发皿④试管夹⑤坩埚⑥玻璃棒⑦石棉网⑧坩埚钳.
| A. | ①④⑤ | B. | ②⑤⑥⑧ | C. | ②③⑥⑧ | D. | ⑤⑥⑦ |
| A. | 低碳生活注重节能减排,减少温室气体的排放 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量 |
| A. | 第一电离能由大到小的顺序为O>N>C | |
| B. | NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 | |
| C. | 由于C22-和O22+为等电子体,所以可以判断O22+的电子式为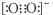 | |
| D. | 液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 用家用汽车代替公交车不能达到节能减排的目的 | |
| C. | 汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾 | |
| D. | 添加三聚氰胺能增加奶制品的N元素含量,但是对人体有害 |
| A. | K+、Na+、MnO4-、SO42- | B. | Fe3+、Na+、HCO3-、Cl- | ||
| C. | K+、Cu2+、S2-、SO42- | D. | Na+、K+、OH-、AlO2- |