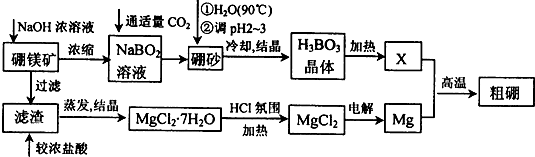
题目内容
13.将38.4g铜投入浓度均为2mol/L的硫酸和硝酸的混合酸溶液200mL中,充分反应后所得溶液中Cu2+的物质的量浓度为(反应前后的溶液体积变化忽略不计)( )| A. | 6 mol/L | B. | 3 mol/L | C. | 2.25mol/L | D. | 1.13 mol/L |
分析 n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,n(HNO3)=n(H2SO4)=2mol/L×0.2L=0.4mol,离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,该溶液中n(H+)=n(HNO3)+2n(H2SO4)=1.2mol,根据方程式知,如果0.6molCu完全溶解需要n(H+)为1.6mol>1.2mol,所以有部分Cu不溶解,如果氢离子完全反应需要n(Cu)=$\frac{1.2mol}{8}×3$=0.45mol,结合Cu原子守恒计算铜离子浓度.
解答 解:n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,n(HNO3)=n(H2SO4)=2mol/L×0.2L=0.4mol,离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,该溶液中n(H+)=n(HNO3)+2n(H2SO4)=1.2mol,根据方程式知,如果0.6molCu完全溶解需要n(H+)为1.6mol>1.2mol,所以有部分Cu不溶解,如果氢离子完全反应需要n(Cu)=$\frac{1.2mol}{8}×3$=0.45mol,结合Cu原子守恒得n(Cu2+)=n(Cu)=0.45mol,c(Cu2+)=$\frac{0.45mol}{0.2L}$=2.25mol/L,故选C.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意根据反应的离子方程式计算,明确物质的过量问题为解答该题的关键,题目难度不大,为易错题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.向密闭容器中充入CO和H2O(g)各0.01 mol,一定温度下发生反应:CO(g)+H2O(g)$?_{高温}^{催化剂}$CO2(g)+H2(g),下列叙述正确的是( )
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
4.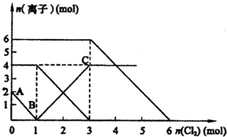 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:2:3 | |
| C. | 原混合溶液中FeBr2的物质的量为6 mol | |
| D. | 当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性.“钴酞菁”的分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法中不正确的是( )
| A. | “钴酞菁”分子既不能透过滤纸,又不能透过半透膜,混有氯化钠的“钴酞菁”可用渗析的方法净化 | |
| B. | “钴酞菁”与水所形成的分散系具有丁达尔效应 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
8.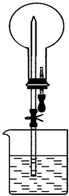 如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
 如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图所示的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )| A. | SO2(饱和NaHSO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | H2S(CuSO4溶液) 黑色喷泉 | D. | HCl(AgNO3溶液) 白色喷泉 |
2.下列特点中,所谓“合金”必须具有的是( )
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
| A. | (1)(2)(3) | B. | (1)(3)(4) | C. | (2)(4) | D. | (1)(4) |
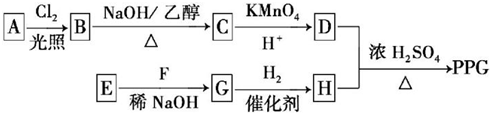
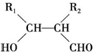 .
. .
. ,反应类型为消去反应.
,反应类型为消去反应. .
. (写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).
(写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).