题目内容
可逆反应2SO2(g)+O2(g)
2SO3(g)正在逆向进行时,正反应速率和逆反应速率的大小是( )
| A、v正>v逆 |
| B、v正<v逆 |
| C、v正=v逆 |
| D、不能确定 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:可逆反应逆向进行,说明逆反应速率大于正反应速率.
解答:
解:可逆反应2SO2(g)+O2(g)
2SO3(g)正在逆向进行时,正反应速率和逆反应速率的大小为:v正<v逆;
故选B.
故选B.
点评:本题考查了化学平衡的建立和反应进行方向分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
关于硝酸的说法正确的是( )
| A、硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
| B、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| C、硝酸与金属反应时,主要是+5价的氮得电子 |
| D、浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 |
下列说法正确的是( )
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2,且熔化时破坏的是离子键和共价键 |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
| A、离子半径:N3->Na+>H+ |
| B、与水反应都是氧化还原反应 |
| C、与盐酸反应都只生成一种盐 |
| D、两种化合物中的阴阳离子均具有相同的电子层结构 |
下列有关说法不正确的是( )
| A、实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B、为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| C、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ?mol-1则水电离的热化学方程式为:H2O(l)?H+(aq)+OH-(aq)△H=+57.3 kJ?mol-1 |
| D、生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e-=Fe2+ |
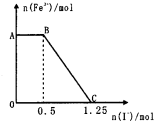 已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 |
| C、向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
| D、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
下列有关化学用语表示正确的是( )
A、中子数为20的氯原子:
| ||
B、CO2的比例模型: | ||
C、铝原子的结构示意图: | ||
D、聚丙烯的结构简式: |