题目内容
13.下列说法正确的是( )| A. | 重结晶是利用混合物中各组分在某种溶剂中的溶解度不同而使它们相互分离的方法 | |
| B. | 蒸馏时,如果温度计水银球的位置偏高,会导致得到的馏分的沸点偏低 | |
| C. | 在氢氧化镁悬浊液中加入氯化铵溶液,悬浊液溶解证明了氯化铵溶液水解呈酸性 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏低 |
分析 A.物质的溶解度受温度影响较大的混合物,可以通过重结晶法分离;
B.温度计水银球的位置偏高,导致得到的馏分的沸点偏高;
C.氢氧化镁溶解的原因是铵根离子与氢氧化镁电离出的氢氧根离子结合,促进了氢氧化镁的电离;
D.锥形瓶不需要润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,导致读出的标准液体积偏大.
解答 解:A.温度影响溶解度,若被提纯物的溶解度随温度变化大,适用重结晶法分离,所以重结晶是利用混合物中各组分在某种溶剂中的溶解度不同而使它们相互分离的方法,故A正确;
B.蒸馏时温度计测定馏分的温度,温度计水银球放在蒸馏烧瓶支管口处,若温度计水银球的位置偏高,将收集到沸点较高的馏分,故B错误;
C.氢氧化镁存在电离平衡:Mg(OH)2(s)?Mg2++2OH-,由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3•H2O,导致反应氢氧化镁的溶解平衡右移,沉淀溶解,不是铵根离子水解的原因,故C错误;
D.用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后不需要用待测液润洗,若碱式滴定管尖嘴部分有气泡,滴定后气泡消失,这样读出的标准液体积偏大,测定结果偏高,故D错误;
故选A.
点评 本题考查了化学实验方案的设计与评价,题目难度不大,涉及重结晶、难溶物溶解平衡、中和滴定、蒸馏等知识,明确常见化学实验基本操作方法为解答关键,注意掌握中和滴定操作及其误差分析方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
7.能使酸性高锰酸钾溶液褪色的有机物是( )
| A. | 苯 | B. | 乙烯 | C. | 甲烷 | D. | 聚乙烯 |
2.3.0gFe2O3和Al2O3组成的混合物全部溶于200mLpH=0的硫酸,反应后向所得溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,则加入的NaOH的浓度c(NaOH)为( )
| A. | 1mol/L | B. | 2mol/L | C. | 4mol/L | D. | 8mol/L |
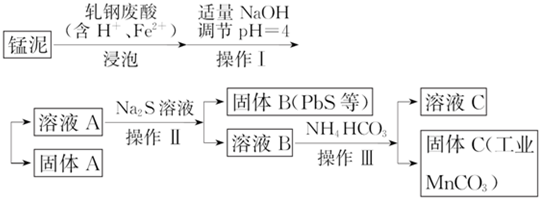

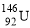

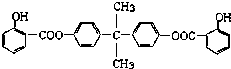
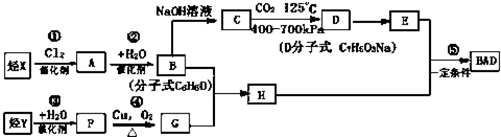
 .
. .F+E
.F+E .
.
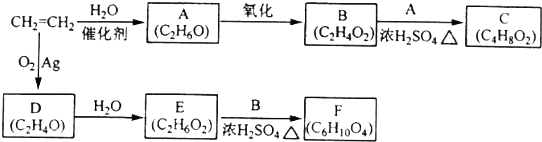
 ;
;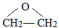 ;
;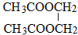 ;
;