题目内容
6.高锰酸钾是强氧化剂,它的用途遍布各个行业.(1)工业上由软锰矿(主要成分为MnO2)生产高锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在阳极区(填“阴极区”或“阳极区”)得到高锰酸钾.阴极反应的电极反应式是2H++2e-=H2↑.
(2)某研究小组用工业生产高锰酸钾产生的废渣--锰泥(含K2MnO4、MnO2及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
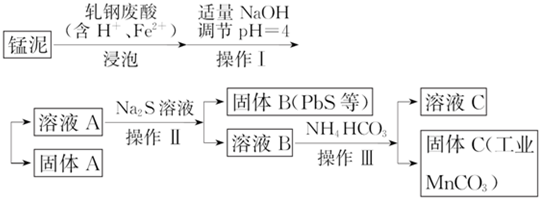
①轧钢废酸中Fe2+的作用是将高价的锰元素还原成Mn2+.
②操作Ⅰ、操作Ⅱ、操作Ⅲ的名称是过滤.
③溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+.
④若固体C中不含CaCO3,则溶液C中$\frac{c(C{a}^{2+})}{c(M{n}^{2+})}$<500.
[已知:Ksp(MnCO3)=1×10-11,Ksp(CaCO3)=5×10-9].
分析 (1)①将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),结合原子守恒配平书写化学方程式;
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,阴极上是溶液中氢离子得到电子生成氢气;
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
①亚铁离子具有还原性还原锰元素为锰离子;
②分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用 过滤操作分离;
③溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
④依据碳酸钙和碳酸锰共存,结合溶度积常数计算分析.
解答 解:(1)①将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),结合原子守恒配平书写化学方程式为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,所以在阳极区发生反应;阴极上是溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,
故答案为:阳极区;2H++2e-=H2↑;
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
①轧钢废酸中Fe2+的作用是,亚铁离子具有还原性,还原锰元素为锰离子;
故答案为:将高价的锰元素还原成Mn2+;
②分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用过滤操作分离;
故答案为:过滤;
③依据流程和加入的试剂分析判断,溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
故答案为:K+、Na+、NH4+;
④依据碳酸钙和碳酸锰共存,结合溶度积常数计计算,则溶液C中$\frac{c(Ca{\;}^{2+})}{c(Mn{\;}^{2+})}$=$\frac{Ksp(CaCO{\;}_{3})}{Ksp(MgCO{\;}_{3})}$=$\frac{5×10{\;}^{-9}}{1×10{\;}^{-11}}$=500,若固体C中不含CaCO3,则溶液C中$\frac{c(C{a}^{2+})}{c(M{n}^{2+})}$<500;
故答案为:500.
点评 本题考查了流程分析,实验基本操作方法,电解原理 分析判断,溶度积常数计算应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$ amol≤n≤$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$amol |
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | ① | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
| A. | 重结晶是利用混合物中各组分在某种溶剂中的溶解度不同而使它们相互分离的方法 | |
| B. | 蒸馏时,如果温度计水银球的位置偏高,会导致得到的馏分的沸点偏低 | |
| C. | 在氢氧化镁悬浊液中加入氯化铵溶液,悬浊液溶解证明了氯化铵溶液水解呈酸性 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏低 |
 。要从水与X的混合物中简便快捷地分离出X,需要用到的仪器是
。要从水与X的混合物中简便快捷地分离出X,需要用到的仪器是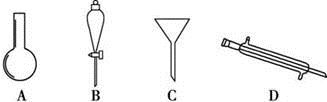

 .
. .
.