题目内容
1.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | HE3中H与E之间以离子键结合 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
分析 短周期元素,A、E有-1价,B有-2价,且A的原子半径与B相差不大,则A、E处于ⅦA族,B处于ⅥA族,A原子半径小于E,可推知A为F、E为Cl,B为O;D有-4、+4价,处于ⅣA族,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于ⅤA族,原子半径大于C原子,应处于第三周期,则G为P元素;H、I、J的化合价分别为+3、+2、+1,分别处于Ⅲ族A、ⅡA族、ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第三周期,可推知H为Al、I为Mg、J为Na,据此解答.
解答 解:短周期元素,A、E有-1价,B有-2价,且A的原子半径与B相差不大,则A、E处于ⅦA族,B处于ⅥA族,A原子半径小于E,可推知A为F、E为Cl,B为O;D有-4、+4价,处于ⅣA族,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于ⅤA族,原子半径大于C原子,应处于第三周期,则G为P元素;H、I、J的化合价分别为+3、+2、+1,分别处于Ⅲ族A、ⅡA族、ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第三周期,可推知H为Al、I为Mg、J为Na.
A.镁在二氧化碳中的燃烧生成MgO和碳单质,故A错误;
B.F-、Na+、Al3+离子核外电子层数相等,核电荷数越大离子半径越小,故离子半径大小顺序为:F->Na+>Al3+,故B错误;
C.AlCl3属于共价化合物,故C错误;
D.氟气能与水反应生成HF与氧气,故D正确.
故选D.
点评 本题考查性质结构位置关系应用,难度中等,根据半径与化合价推断元素是解题关键,注意掌握元素周期律,熟练掌握元素化合物结构与性质.

练习册系列答案
相关题目
11.以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌.
Ⅰ.制取氯化锌主要工艺如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
回答下列问题:
(1)为了加快反应,“酸溶”需要适当加热,但是温度不宜太高,原因是防止金属离子水解形成沉淀,以及温度过高H2O2发生分解.
(2)沉淀A的化学式为Cu.
(3)调节pH的范围为3.2≤pH<5.2;若试剂X为Zn2(OH)2CO3,加人X除杂质的离子方程为Zn2(OH)2CO3+4H+=2Zn2++3H2O+CO2↑.
Ⅰ.制取氯化锌主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
(1)为了加快反应,“酸溶”需要适当加热,但是温度不宜太高,原因是防止金属离子水解形成沉淀,以及温度过高H2O2发生分解.
(2)沉淀A的化学式为Cu.
(3)调节pH的范围为3.2≤pH<5.2;若试剂X为Zn2(OH)2CO3,加人X除杂质的离子方程为Zn2(OH)2CO3+4H+=2Zn2++3H2O+CO2↑.
12.下列叙述不正确的是( )
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
16.3.2g O2的物质的量为﹙﹚
| A. | 1mol | B. | 0.1mol | C. | 2mol | D. | 0.5mol |
6.下列物质用途错误的是( )
| A. | 天然气用做燃料 | B. | 无水乙醇直接用作医用消毒 | ||
| C. | 苯酚用于制杀菌剂 | D. | 福尔马林用于浸制生物标本 |
13.有下列八种晶体:①晶体硅 ②汞 ③氯化钾 ④二氧化硅 ⑤晶体碘 ⑥溴化钠 ⑦镁 ⑧二氧化碳.
其中属于金属晶体的是②⑦(填序号,下同)
属于原子晶体的是①④
属于离子晶体的是③⑥
属于分子晶体的是⑤⑧.
其中属于金属晶体的是②⑦(填序号,下同)
属于原子晶体的是①④
属于离子晶体的是③⑥
属于分子晶体的是⑤⑧.
10.某元素的一种同位素X原子的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX分子中含质子的物质的量是( )
| A. | $\frac{a}{A+m}$(A+N+m)mol | B. | $\frac{a}{A+m}$(A-N+m)mol | C. | $\frac{a}{A+m}$( A-N)mol | D. | $\frac{a}{A+m}$(A-N)mol |
 .
.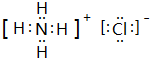 ,A2C2的电子式为
,A2C2的电子式为 .
.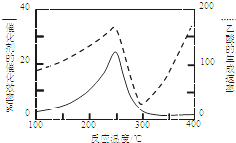 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.