题目内容
2.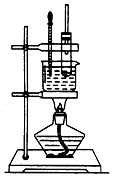 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白:(1)配制一定比例的浓H2SO4和浓HNO3混合酸时,操作注意事项是将浓H2SO4慢慢倒入浓HNO3中,并不断搅拌.
(2)为了使反应在50~60℃下进行,常用的方法是水浴加热.
(3)洗涤和分离粗硝基苯应使用的仪器是分液漏斗.
(4)纯硝基苯是无色,密度比水大(填“小”或“大”),具有苦杏仁味的油状液体.
分析 (1)混合酸液时,应防止酸液暴沸;
(2)为了使反应在50~60℃下进行,可采用水浴加热;
(3)硝基苯不溶于水;
(4)纯硝基苯密度比水大,为无色油状液体.
解答 解:(1)浓硫酸密度比水大,溶于水放出大量的热,混合酸液时,应防止酸液暴沸,可将浓H2SO4慢慢倒入浓HNO3中,并不断搅拌,故答案为:将浓H2SO4慢慢倒入浓HNO3中,并不断搅拌;
(2)为了使反应在50~60℃下进行,可采用水浴加热,故答案为:水浴加热;
(3)硝基苯不溶于水可用分液漏斗进行分液,故答案为:分液漏斗;
(4)纯硝基苯密度比水大,为无色油状液体,具有苦杏仁味,故答案为:大;苦杏仁.
点评 本题考查硝基苯制备实验的有关判断,该题是基础性试题的考查,试题注重基础,只要是考查学生对硝基苯制备实验的了解掌握程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的实验能力,和严禁的逻辑思维能力.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
1.高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,具有能量密度大、体积小、重量轻、寿命长、无污染等优点,除比亚迪外目前还没有其他厂家宣称其产品可以大规模实用化.电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
| A. | 充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4发生反应,转移电子数约为1.806×1024 | |
| C. | 充电时K2FeO4发生氧化反应 | |
| D. | 放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
13. 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
Ⅰ催化还原法.在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质.主要反应如下::2NO(g)+2CO(g)?N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-751kJ•mol-1
(2)在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)?N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示.
①前10分钟内用氮气表示的反应速率为0.02mol?L-1?min-1,计算该温度下反应的平衡常数K为$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$L?mol-1.(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO1.6mol、CO20.4mol,则此时反应的ν正=ν逆(填“<”、“=”或“>”)
程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$ NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}水溶液}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;
若生成11.2L N2(标准状况),则消耗ClO267.5g.
 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.Ⅰ催化还原法.在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质.主要反应如下::2NO(g)+2CO(g)?N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
| 化学键 | O═O | C═O | C≡O |
| 键能(Kj/moL) | 497 | 803 | 1072 |
(2)在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)?N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示.
①前10分钟内用氮气表示的反应速率为0.02mol?L-1?min-1,计算该温度下反应的平衡常数K为$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$L?mol-1.(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO1.6mol、CO20.4mol,则此时反应的ν正=ν逆(填“<”、“=”或“>”)
程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$ NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}水溶液}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;
若生成11.2L N2(标准状况),则消耗ClO267.5g.
10.某有机物的结构简式为HOOC-CH=CH-CH2OH,关于该有机物下列说法错误的是( )
| A. | 该物质有三种官能团,该物质自身能发生酯化反应 | |
| B. | 该物质能使酸性高锰酸钾溶液和溴水褪色,它们的反应原理相同 | |
| C. | 该物质能通过两种方式的反应生成两种高分子物质 | |
| D. | 1mol该物质能够消耗2mol金属钠同时放出1mol氢气 |
17.下列有关实验操作、现象、解释和结论都正确的是( )
| 选项 | 操 作 | 现 象 | 解释、结论 |
| A | 把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | 定容时不小心加水超过容量瓶的刻度线,立即用滴管吸去多余的部分 | 液体凹液面与刻度线相平 | 配制溶液的浓度不受影响 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
7.有四种有机物A、B、C、D,其分子式均为C3H6O2,把它们分别进行实验并记录现象如表:
四种物质的结构简式为:
A.CH3CH2COOH;B.CH3CHOHCHO;C.HCOOCH2CH3;D.CH3COOCH3.
| 有机物 | 氢氧化钠 | 银氨溶液 | 新制氢氧化铜 | 金属钠 |
| A | 发生中和反应 | 不反应 | 溶解 | 放出氢气 |
| B | 不反应 | 发生银镜反应 | 生成红色沉淀 | 放出氢气 |
| C | 不反应 | 发生银镜反应 | 生成红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
A.CH3CH2COOH;B.CH3CHOHCHO;C.HCOOCH2CH3;D.CH3COOCH3.
14.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | 粗硅$→_{高温}^{Cl_{2}}$ SiCl4$→_{高温}^{H_{2}}$ Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$ MgCl2(aq)$\stackrel{电解}{→}$ Mg | |
| C. | Fe2O3$\stackrel{盐酸}{→}$ FeCl3(aq)$\stackrel{蒸发}{→}$ 无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$ OH(aq)$→_{△}^{蔗糖}$ Ag |
11.下列反应中必须加入氧化剂才能进行的是( )
| A. | SO32-→SO42- | B. | CO32-→CO2 | C. | Fe3+→Fe2+ | D. | MnO4-→Mn2+ |