题目内容
12.现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)④②③①.
(2)将③和②等体积混合后,混合液中各离子浓度由大到小的顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(3)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”)>25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=9:2.
分析 (1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大其抑制水电离程度越大;
(2)将③和②等体积混合后,二者恰好完全反应生成醋酸钠,醋酸钠是强碱弱酸盐,其水溶液呈碱性,结合电荷守恒判断离子浓度大小顺序;
(3)水的电离是吸热反应,升高温度促进水电离,其离子积常数增大;该温度下pH=11的NaOH浓度为0.01mol/L、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,二者混合后pH=2,则混合溶液中氢离子浓度为0.01mol/L.
解答 解:(1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大其抑制水电离程度越大,①②③抑制水电离、④促进水电离,氢离子浓度:①>②,碱中氢氧根离子浓度③
小于①中氢离子浓度而大于②中氢离子浓度,①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,
故答案为:④②③①;
(2)将③和②等体积混合后,二者恰好完全反应生成醋酸钠,醋酸钠是强碱弱酸盐,其水溶液呈碱性,c(OH-)>c(H+),结合电荷守恒得c(Na+)>c( CH3COO-),水电离程度较小,则离子浓度大小顺序是c(Na+)>c( CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c( CH3COO-)>c(OH-)>c(H+)
(3)水的电离是吸热反应,升高温度促进水电离,其离子积常数增大,Kw=1×10-13>1×10-14,则t℃>25℃;该温度下pH=11的NaOH浓度为0.01mol/L、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,二者混合后pH=2,则混合溶液中氢离子浓度为0.01mol/L=$\frac{0.1b-0.01a}{a+b}$mol/L,则a:b=9:2,
故答案为:>;9:2.
点评 本题考查离子浓度大小比较、酸碱混合溶液定性判断等知识点,为高频考点,侧重考查学生分析、判断及计算能力,明确溶液中溶质成分及其性质是解本题关键,会正确计算混合溶液pH,题目难度不大.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 苯酚呈弱酸性,能够使石蕊试液显红色 | |
| B. | 提纯含有少量苯酚的苯:向含有少量的苯酚的苯中加入过量的浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| C. | 苯酚能够与氯化铁溶液反应生成紫色沉淀 | |
| D. | 苯酚分子中的13个原子可能处于同一平面上 |
| A. | 向Na2CO3溶液中通入NH3,$\frac{c(N{a}^{+})}{c(C{{O}_{3}}^{2-})}$减小 | |
| B. | 将0.1mol•L-1的K2C2O4溶液从25℃升温至35℃,$\frac{c({K}^{+})}{c({C}_{2}{{O}_{4}}^{2-})}$增大 | |
| C. | 向0.1mol•L-1的HF溶液中滴加NaOH溶液至中性,$\frac{c(N{a}^{+})}{c({F}^{-})}$=1 | |
| D. | 向0.1mol•L-1的CH3COONa溶液中加入少量水,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$增大 |
| A. | HBr | B. | CH3COOH | C. | BaSO4 | D. | CH3COONa |
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 五种物质在常温下溶解度最大的是Ag 2SO4 | |
| B. | 将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀 | |
| C. | 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 | |
| D. | 常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大 |
| A. | 向某溶液中加入硝酸银溶液,白色沉淀生成,证明原溶液是盐酸 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 向某溶液中加少量氯化钡溶液,若出现白色沉淀,说明原溶液中含有SO42- | |
| D. | 向某溶液中加入少量稀盐酸,产生的气体能使澄清石灰水变浑浊,则原溶液一定含CO32- |
| A. | 用湿润的蓝色石蕊试纸检验氨气 | |
| B. | 当浓氨水与浓硫酸反应会产生白烟 | |
| C. | 只用BaCl2溶液就可以鉴别SO42-和CO32- | |
| D. | 在化学实验中,点燃可燃性气体均需要验纯 |
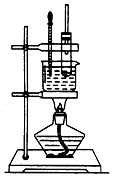 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白: 有A、B是钠的两种常见的化合物的混合物,其相互转化关系如图(其他略去)
有A、B是钠的两种常见的化合物的混合物,其相互转化关系如图(其他略去)