题目内容
 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:(1)元素x在周期表中的位置是第
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是
(3)气体分子(mn)2的电子式为
考点:真题集萃,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:这几种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期,x原子核外电子数是m的2倍,y的氧化物具有两性,则y是Al元素,根据元素位置知,x是Mg元素、m是C元素、n元素N元素,再结合题目分析解答.
解答:
解:这几种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期,x原子核外电子数是m的2倍,y的氧化物具有两性,则y是Al元素,根据元素位置知,x是Mg元素、m是C元素、n元素N元素,
(1)元素x是Mg元素,在周期表中的位置是第三周期第IIA族,其单质可以采用电解熔融氯化镁的方法制备,
故答案为:三;IIA;氯化镁;
(2)m、n、y分别是C、N、Al,元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这三种元素金属性最强的是Al元素、非金属性最强的是N元素,所以酸性最强的是HNO3,碱性最强的是Al(OH)3,
故答案为:HNO3;Al(OH)3;
(3)气体分子(mn)2为(CN)2,电子式为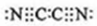 ,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,故答案为:
,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,故答案为: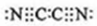 ;2NaOH+(CN)2=NaCN+NaOCN+H2O.
;2NaOH+(CN)2=NaCN+NaOCN+H2O.
(1)元素x是Mg元素,在周期表中的位置是第三周期第IIA族,其单质可以采用电解熔融氯化镁的方法制备,
故答案为:三;IIA;氯化镁;
(2)m、n、y分别是C、N、Al,元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这三种元素金属性最强的是Al元素、非金属性最强的是N元素,所以酸性最强的是HNO3,碱性最强的是Al(OH)3,
故答案为:HNO3;Al(OH)3;
(3)气体分子(mn)2为(CN)2,电子式为
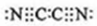 ,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,故答案为:
,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,故答案为: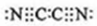 ;2NaOH+(CN)2=NaCN+NaOCN+H2O.
;2NaOH+(CN)2=NaCN+NaOCN+H2O.
点评:本题考查了元素周期表和元素周期律的综合应用,根据元素在周期表中物质及元素性质确定元素,再结合物质的性质分析解答,采用知识迁移的方法分析解答(3)题,题目难度中等.

练习册系列答案
相关题目
下列物质分类正确的是( )
| A、碱性氧化物均为金属氧化物 |
| B、SO2、SiO2、CO均为酸性氧化物 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、硫酸、KAl(SO4)2﹒12H2O属于混合物 |
已知NH4Ac溶液呈中性,一种c(H+)=10-3mol/L的酸a和pH=11的氨水b以等体积混合后,溶液呈碱性,关于酸a说法正确的是( )
| A、酸a的浓度可能大于b |
| B、酸a的浓度可能等于b |
| C、酸a的酸性比醋酸弱 |
| D、酸a可能是强酸可能是弱酸 |
1L0.1mol/L的NH4Cl溶液与1L0.1mol/L NaCl溶液相比较,两者所含离子总数( )
| A、前者大 | B、后者大 |
| C、相等 | D、无法确定 |
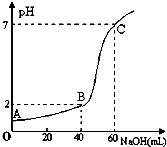 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、A、B、C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
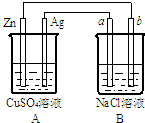 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L. 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=