题目内容
14.常温下,现有浓度均为0.1mol/L的七种溶液:①NaOH溶液 ②氨水 ③盐酸 ④醋酸⑤硫酸 ⑥(NH4)2SO4⑦CH3COONa溶液,回答下列问题:
(1)由水电离出的c(H+)最大的是⑥,最小的是⑤(填序号);
(2)向等体积③、④、⑤溶液中分别加入溶液①,则消耗溶液①的体积由多到少的顺序是③=④<⑤(填序号);
(3)将①和④等体积混合后溶液的pH>7(填“>”“<”或“=”),其原因是CH3COO-+H2O?CH3COOH+OH-(用离子方程式表示);
(4)将①和⑥等体积混合后溶液呈中性,则c(Na+)+c(NH4+)= 2c(SO42-)(填“>”“<”或“=”);
(5)将④和⑦等体积混合后,若溶液中c(CH3COO-)>c(Na+),则c(CH3COOH)< c(CH3COO-),c(CH3COO-)+c(OH-)>0.05mol/L(填“>”“<”或“=”).
分析 常温下,现有浓度均为0.1mol/L的七种溶液:①NaOH溶液属于强碱,②氨水属于弱碱,③盐酸是强酸,④醋酸是弱酸,⑤硫酸是二元强酸,⑥(NH4)2SO4 是强酸弱碱盐,铵根离子水解溶液显酸性,⑦CH3COONa是强碱弱酸盐,醋酸根离子水解溶液显碱性;
(1)酸、碱抑水的电离,水解的盐促进水的电离;
(2)等体积等浓度的溶液③盐酸是强酸,④醋酸是弱酸,⑤硫酸是二元强酸,加入溶液①NaOH溶液,消耗氢氧化钠溶液体积结合H++OH-=H2O分析;
(3)①NaOH溶液④醋酸等浓度等体积混合反应生成醋酸钠溶液,醋酸根离子水解溶液显碱性;
(4)①NaOH溶液,⑥(NH4)2SO4等体积混合后溶液呈中性,结合溶液中电荷守恒计算分析判断;
(5)④醋酸⑦CH3COONa溶液等体积混合后,依据溶液中电荷守恒和物料守恒分析判断.
解答 解:(1)酸、碱抑水的电离,水解的盐促进水的电离,⑥(NH4)2SO4⑦CH3COONa溶液中盐类水解促进水的电离,⑥(NH4)2SO4溶液中铵根离子水解溶液显酸性,由水电离出的c(H+)最大的是⑥,①NaOH溶液属于强碱,②氨水属于弱碱,③盐酸是强酸,④醋酸是弱酸,⑤硫酸是二元强酸都对水的电离平衡起到抑制作用,其中硫酸是二元强酸对水的电离抑制程度最大,由水电离出的c(H+)最小,
故答案为:⑥;⑤;
(2)等体积等浓度的溶液③盐酸是强酸,④醋酸是弱酸,⑤硫酸是二元强酸,加入溶液①NaOH溶液,消耗氢氧化钠溶液体积结合H++OH-=H2O可知,③=④=$\frac{1}{2}$⑤,
故答案为:③=④<⑤;
(3)①NaOH溶液④醋酸等浓度等体积混合反应生成醋酸钠溶液,醋酸根离子水解溶液显碱性,溶液PH>7,CH3COO-+H2O?CH3COOH+OH-,
故答案为:>;CH3COO-+H2O?CH3COOH+OH-;
(4)①NaOH溶液,⑥(NH4)2SO4等体积混合后溶液呈中性,c(H+)=c(OH-),溶液中电荷守恒c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),得到c(Na+)+c(NH4+)=2c(SO42-),
故答案为:=;
(5)④醋酸⑦CH3COONa溶液等体积混合后,溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),若溶液中c(CH3COO-)>c(Na+),则c(H+)>c(OH-),溶液显酸性,说明醋酸电离程度大于醋酸根离子的水解程度,c(CH3COOH)<c(CH3COO-),等体积混合后c(Na+)=0.05mol/L,则c(CH3COO-)+c(OH-)>0.05mol/L,
故答案为:<;>.
点评 本题考查了弱电解质的电离平衡、盐类的水解、溶液中离子浓度大小的比较,主要是离子浓度大小的比较,可根据物料守恒、电荷守恒进行分析判断,题目难度中等.

| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
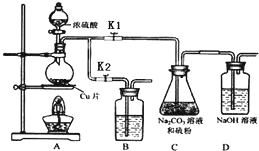 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:
①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-
(Ⅰ)制备Na2S2O3•5H2O
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热.圆底烧瓶中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.
C中碳酸钠的作用是提供碱性环境,作反应物.D中可能发生的离子反应方程式为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.“停止C中的反应”的操作
是打开K2,关闭K1.
③过滤C中的混合液.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(Ⅱ)用I2的标准溶液测定产品的纯度取5.5g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
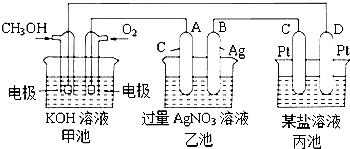
(2)根据选择电解质溶液的不同,填写下表:
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
| A. | NO2 | B. | SO2 | C. | CO2 | D. | Cl2 |
| A. | 体积比1:1 | B. | 体积比11:16 | C. | 分子个数比1:1 | D. | 密度比11:16 |
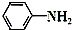 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$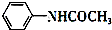 +H2O
+H2O已知:①苯胺易被氧化; ②苯胺、醋酸和乙酰苯胺的部分物理性质如表:
| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
步骤1:在下图1装置的圆底烧瓶中,加入6.0mL苯胺、9.0mL冰醋酸及0.2g锌粉.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,抽滤,洗涤,得到粗产品.
步骤4:通过重结晶提纯粗产品后,获得无色片状晶体,干燥后得目标产品.
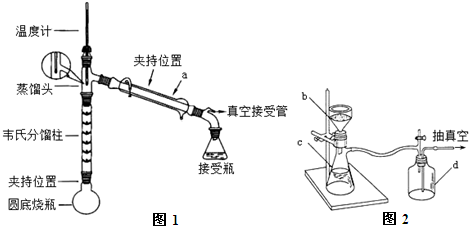
(1)仪器a的名称为冷凝管.
(2)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中控制温度计示数约105℃的原因是乙酸有挥发性,温度过高,乙酸蒸出,降低了反应物的利用率,而温度过低,不能除去反应生成水.
(4)步骤3中,抽滤装置如图2所示,仪器c的名称是吸滤瓶,当过滤的溶液具有强酸性、强碱性或强氧化性时要用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗,停止抽滤时的操作为先旋开安全瓶d上的旋塞恢复常压然后关闭抽气泵.
 图是一个化学过程的示意图.
图是一个化学过程的示意图.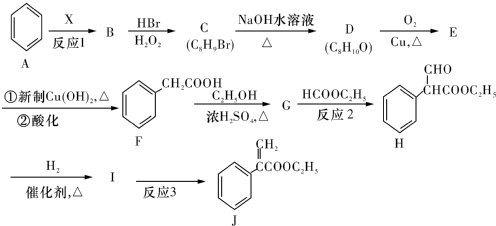
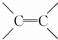 (或碳碳双键).
(或碳碳双键). .
.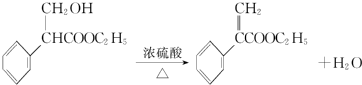 .
.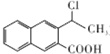 为起始原料制备
为起始原料制备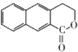 的合成路线
的合成路线 .
.