题目内容
1.金属铁在氧气中燃烧,实验现象是( )| A. | 产生苍白色火焰 | B. | 产生淡黄色火焰 | C. | 出现火星四射 | D. | 产生耀眼白光 |
分析 铁丝在氧气中剧烈燃烧,火星四射.
解答 解:铁丝在氧气中剧烈燃烧,火星四射,生成黑色的固体,故选:C.
点评 本题难度不大,掌握常见铁丝在氧气中燃烧的现象即可正确解答,注意基础知识的积累.

练习册系列答案
相关题目
16.下列物质互为同分异构体的一组是( )
| A. | 白磷和红磷 | B. | 甲烷和丙烷 | ||
| C. | 1H和2H | D. | CH3CH2OH和CH3OCH3 |
9.已知:Ksp[Mg(OH)2]=1.8×10-11 Ksp[Zn(OH)2]=1.0×10-17
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
16.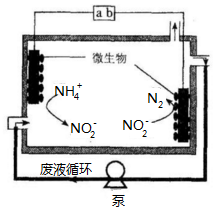 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )| A. | a为电源的负极 | |
| B. | 右侧电极反应式为:2NO2-+6e-+4 H+=N2↑+4OH- | |
| C. | 电池工作一段时间后,溶液中NO2-的浓度不变 | |
| D. | 每通过3mol电子,最多处理0.5mol NH4+ |
6.下列变化属于放热反应的是( )
①碳与二氧化碳化合 ②生石灰与水反应生成熟石灰 ③Zn与稀硫酸反应
④浓硫酸溶于水 ⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥甲烷与氧气的燃烧.
①碳与二氧化碳化合 ②生石灰与水反应生成熟石灰 ③Zn与稀硫酸反应
④浓硫酸溶于水 ⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥甲烷与氧气的燃烧.
| A. | ①②④⑥ | B. | ①④⑤ | C. | ②③⑥ | D. | ②④⑥ |
13.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
| A. | 偏二甲肼(C2H8N2)的摩尔质量为60g | |
| B. | 火箭发射时,偏二甲肼(C2H8N2)燃烧生成CO2、N2、H2O | |
| C. | 偏二甲肼(C2H8N2)中所有原子最外层都达到8个电子 | |
| D. | 从能量变化看,主要是化学能转变为热能和动能,它是一种能量很高的烃 |
10.铅蓄电池是常见的二次电池,某学生用铅蓄电池进行下列实验,如图所示.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列判断错误的是( )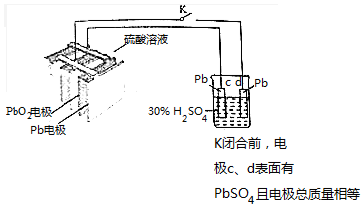

| A. | 铅蓄电池的结构中栅状极板应交替排列 | |
| B. | 铅蓄电池放电时Pb电极的电极反应为:Pb-2e-═Pb2+ | |
| C. | K闭合时,烧杯中SO42-向c电极迁移 | |
| D. | K闭合后,若c、d电极的质量相差3.2g,则转移的电子可能为0.2mol |
11.电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )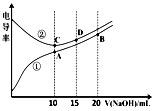

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |