题目内容
14.在1L密闭容器中加入1molN2和3molH2,一定条件下发生反应:N2+3H2?2NH3,1min后测得生成0.06molNH3,该时间段内平均反应速率为( )| A. | v(NH3)=0.06mol.L-1•min-1 | B. | v(H2)=0.04mol.L-1•min-1 | ||
| C. | v(NH3)=0.12mol.L-1•min-1 | D. | v(N2)=0.24mol.L-1•min-1 |
分析 结合化学反应速率概念计算氨气的反应速率v(NH3),依据速率之比等于化学方程式中计量数之比计算其他物质表示的化学反应速率,据此分析判断;
解答 解:在1L密闭容器中加入1molN2和3molH2,一定条件下发生反应:N2+3H2?2NH3,1min后测得生成0.06molNH3,v(NH3)=$\frac{\frac{0.06mol}{1L}}{1min}$=0.06mol/(L•min),速率之比等于化学方程式计量数之比,v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×0.06mol/(L•min)=0.09mol.L-1•min-1 ,v(N2)=$\frac{1}{2}$v(NH3)=0.03mol/(L•min),故选A.
点评 本题考查了化学反应速率概念的硫酸与计算,注意同一反应化学反应速率之比等于其计量数之比,题目难度不大.

练习册系列答案
相关题目
4.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,X与Y的原子序数之和为Z与W原子序数之和的$\frac{2}{3}$.下列说法正确的是( )
| X | |||
| Y | Z | W | |
| T |
| A. | Mg在一定条件下可以和YX2发生反应生成Y单质 | |
| B. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| C. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| D. | 五种元素中,只有T是金属元素 |
2.在体积为2L的密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2+O2?2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
| A. | 小于1.2 mol | B. | 1.2 mol | C. | 大于1.6 mol | D. | 1.6 mol |
9.下列元素中,非金属性最强的是( )
| A. | S | B. | Mg | C. | P | D. | Cl |
19.已知某溶液中存在H+、Ba2+、Fe3+三种阳离子,则其中可能大量存在的阴离子是( )
| A. | SO42- | B. | CO32- | C. | NO3- | D. | OH- |
6.为除去氯化氢中混有的少量水蒸气,可使气体通过洗气瓶,洗气瓶中应盛有( )
| A. | 硝酸银溶液 | B. | 浓硫酸 | C. | 纯碱溶液 | D. | 碱石灰 |
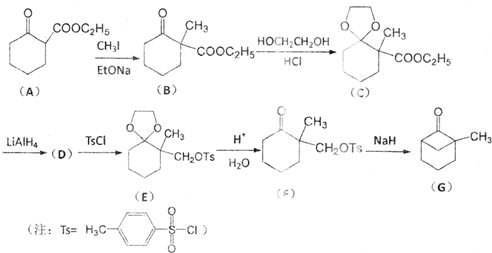
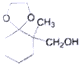 ;
; )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(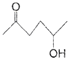 )的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
)的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH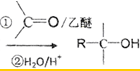
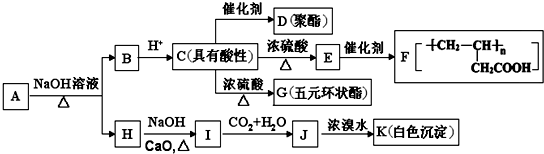
 +NaOH$→_{△}^{CaO}$R-H+Na2CO3
+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为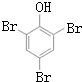 .
.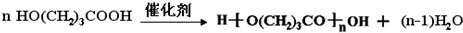 ;
;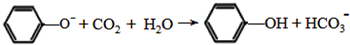 .
. (写结构简式).
(写结构简式).