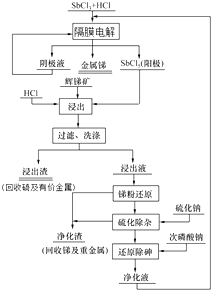
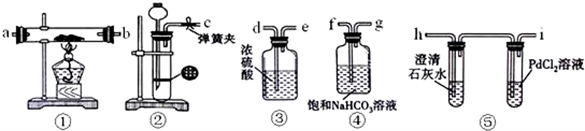
题目内容
3.含3.01×1023个氢原子的H2SO4的物质的量为0.25mol,质量为24.5g,其中含氧原子的物质的量为1mol.分析 结合n=$\frac{N}{{N}_{A}}$、m=nM及分子构成计算.
解答 解:n(H)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,则n(H2SO4)=0.5mol×$\frac{1}{2}$=0.25mol,其质量为0.25mol×98g/mol=24.5g,n(O)=0.25mol×4=1mol,
故答案为:0.25mol;24.5g;1mol.
点评 本题考查物质的量的计算,为高频考点,把握微粒数、物质的量、质量的关系为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
13.某种食用精制盐包装袋上有如表说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
14.在1L密闭容器中加入1molN2和3molH2,一定条件下发生反应:N2+3H2?2NH3,1min后测得生成0.06molNH3,该时间段内平均反应速率为( )
| A. | v(NH3)=0.06mol.L-1•min-1 | B. | v(H2)=0.04mol.L-1•min-1 | ||
| C. | v(NH3)=0.12mol.L-1•min-1 | D. | v(N2)=0.24mol.L-1•min-1 |
11.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量.下列关于氮肥的说法错误的是( )
| A. | 尿素CO(NH2)2是一种氮肥 | |
| B. | 储存碳酸氢铵时,应密封并置于阴凉通风处 | |
| C. | 铵态氮肥不能与碱性物质如草木灰等混合施用 | |
| D. | 氮肥溶于水,其中的氮元素均以铵离子形式在存 |
6.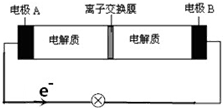 如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )
如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )
 如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )
如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )| A. | 充电时,A极应与直流电源正极相连接 | |
| B. | 放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 | |
| C. | 放电时,钠离子从左到右通过离子交换膜 | |
| D. | 放电时,负极反应式为3NaBr-2e-═NaBr3+2Na+ |
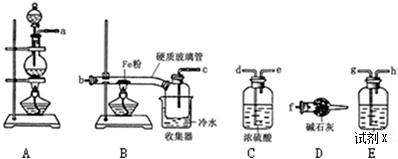

 CH3COOCH2CH3+H2O,酯化(或取代)反应.
CH3COOCH2CH3+H2O,酯化(或取代)反应.