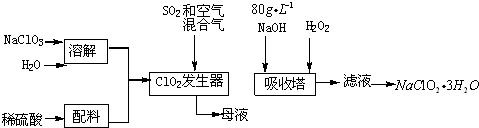
题目内容
5.有机物G是一种重要的有机合成中间体,可通过以下方法合成: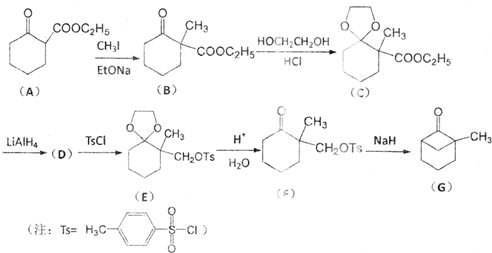
(1)写出A中含氧官能团的名称:羰基和酯基.
(2)写出D的结构简式:
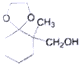 ;
;(3)将B转化为化合物C的反应目的是保护羰基;
(4)写出一种符合下列条件的化合物C的同分异构体的结构简式:(CH3)3COOCCH=CHCOOC(CH3)3或(CH3)3COOCCH=CHOOCC(CH3)3;
①能发生水解反应
②能使溴的CCl4溶液褪色
③分子中有2种不同化学环境的氢原子
(5)根据己有知识并结合相关信息写出以丁烯酮(
 )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
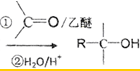
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(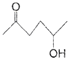 )的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
)的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH己知:卤代烃可以和Mg生成格氏试剂(RMgX ),醛或酮可以和格氏试剂反应:
RX$→_{干醚}^{Mg}$RMgX
分析 (1)根据A的结构简式可知其中含有的含氧官能团;
(2)比较C和E的结构简式可知,C发生还原得D,D发生取代反应生成E,据此可判断D的结构简式;
(3)比较B和F的结构简式及B生成C、E生成F的过程可知,将B转化为化合物C的反应目的是保护保护羰基,据此答题;
(4)根据条件①能发生水解反应,说明有酯基,②能使溴的CCl4溶液褪色,说明有碳碳双键,③分子中有2种不同化学环境的氢原子,结合C的结构简式可书写出同分异构体;
(5)以丁烯酮( )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮( ),可以用丙烯酮与溴化氢加成,再与乙二醇反应保护碳氧双键,后与镁反应,再与乙醛反应可得,据此答题;
),可以用丙烯酮与溴化氢加成,再与乙二醇反应保护碳氧双键,后与镁反应,再与乙醛反应可得,据此答题;
解答 解:(1)根据A的结构简式可知其中含有的含氧官能团为羰基、酯基,
故答案为:羰基、酯基;
(2)比较C和E的结构简式可知,C发生还原得D,D发生取代反应生成E,据此可判断D的结构简式为 ,
,
故答案为: ;
;
(3)比较B和F的结构简式及B生成C、E生成F的过程可知,将B转化为化合物C的反应目的是保护保护羰基,
故答案为:保护羰基;
(4)根据条件①能发生水解反应,说明有酯基,②能使溴的CCl4溶液褪色,说明有碳碳双键,③分子中有2种不同化学环境的氢原子,结合C的结构简式可知符合条件的同分异构体为(CH3)3COOCCH=CHCOOC(CH3)3或(CH3)3COOCCH=CHOOCC(CH3)3,
故答案为:(CH3)3COOCCH=CHCOOC(CH3)3或(CH3)3COOCCH=CHOOCC(CH3)3;
(5)以丁烯酮( )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮( ),可以用丙烯酮与溴化氢加成,再与乙二醇反应保护碳氧双键,后与镁反应,再与乙醛反应可得,合成路线为
),可以用丙烯酮与溴化氢加成,再与乙二醇反应保护碳氧双键,后与镁反应,再与乙醛反应可得,合成路线为 ,
,
故答案为: .
.
点评 本题考查有机物推断与合成、有条件的同分异构体等,关键是理解合成路线中各官能团的转化,注意利用有机物分子式与反应条件进行推断,明确有机物的断键和成键方式是解决有机题的关键,难度中等.

| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
| A. |  可用装置甲制取氯气 | |
| B. | 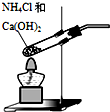 可用装置乙制取氨气 | |
| C. | 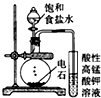 可用装置丙制取并检验乙炔(乙炔中含有H2S、PH3) | |
| D. | 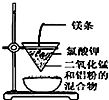 可用装置丁制得金属锰 |
| A. | 氯气:K+ Ba2+ SiO32- NO3- | |
| B. | 氨气:K+ Na+ AlO2- CO32- | |
| C. | 二氧化硫:Na+ NH4+ SO32- C1- | |
| D. | 甲醛:Ca2+ Mg2+ Mn04- NO3- |
| A. | v(NH3)=0.06mol.L-1•min-1 | B. | v(H2)=0.04mol.L-1•min-1 | ||
| C. | v(NH3)=0.12mol.L-1•min-1 | D. | v(N2)=0.24mol.L-1•min-1 |