题目内容
4.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,X与Y的原子序数之和为Z与W原子序数之和的$\frac{2}{3}$.下列说法正确的是( )| X | |||
| Y | Z | W | |
| T |
| A. | Mg在一定条件下可以和YX2发生反应生成Y单质 | |
| B. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| C. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| D. | 五种元素中,只有T是金属元素 |
分析 X、Y、Z、W为短周期元素,X为第二周期元素,Y、Z、W均为第三周期,设X的原子序数为x,Y的原子序数为x+6,Z的原子序数为x+8,W的原子序数为x+9,结合X与Y的原子序数之和为Z与W原子序数之和的$\frac{2}{3}$,则x+x+6=(x+8+x+9)×$\frac{2}{3}$,解得x=8.结合元素在周期表的位置可知,X为O,Z为S,W为Cl,Y为Si,T为Se,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、W为短周期元素,X为第二周期元素,Y、Z、W均为第三周期,设X的原子序数为x,Y的原子序数为x+6,Z的原子序数为x+8,W的原子序数为x+9,结合X与Y的原子序数之和为Z与W原子序数之和的$\frac{2}{3}$,则x+x+6=(x+8+x+9)×$\frac{2}{3}$,解得x=8.结合元素在周期表的位置可知,X为O,Z为S,W为Cl,Y为Si,T为Se,
A.Mg与二氧化硅发生氧化还原反应生成Si,故A正确;
B.化合物SiO2、SO2化学键均为共价键,晶体类型分别为原子晶体、分子晶体,故B错误;
C.非金属性W>Z>T,T、Z、W三种元素最高价氧化物的水化物的酸性依次增强,故C错误;
D.由上述分析可知,均为非金属元素,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意利用原子序数推断元素为解答的突破口,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
14. 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )| A. | 能发生取代反应、加成反应、消去反应 | |
| B. | 1mol该物质中含有苯环的物质的量为1mol | |
| C. | 该物质在酸性条件下加热水解可以得到乙醇 | |
| D. | 与足量NaOH溶液反应,最多消耗4nmolNaOH |
12.下列实验装置能达到实验目的是( )
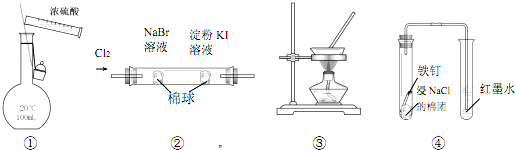

| A. | 图①装置可用于配制 100 mL 0.1 mol/L的硫酸 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
19.下列有关乙酸的说法正确的是( )
| A. | pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合所得溶液的pH<7 | |
| B. | 反应2CO(g)+2H2(g)→CH3COOH (l)的△S>0 | |
| C. | 冰醋酸用水稀释,溶液中c(H+)先变大后变小 | |
| D. | 含有CH3COOH、C2H5OH、CH3COOC2H5及H2O的平衡体系中加入少量浓硫酸,CH3COOC2H5的物质的量不变 |
13.某种食用精制盐包装袋上有如表说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
14.在1L密闭容器中加入1molN2和3molH2,一定条件下发生反应:N2+3H2?2NH3,1min后测得生成0.06molNH3,该时间段内平均反应速率为( )
| A. | v(NH3)=0.06mol.L-1•min-1 | B. | v(H2)=0.04mol.L-1•min-1 | ||
| C. | v(NH3)=0.12mol.L-1•min-1 | D. | v(N2)=0.24mol.L-1•min-1 |
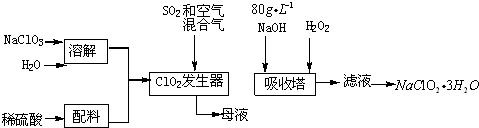
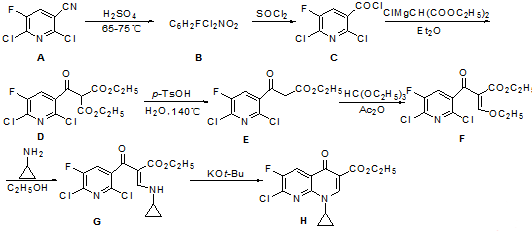
 .由C→D的反应类型是取代反应.
.由C→D的反应类型是取代反应. (其中一种).
(其中一种).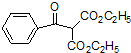 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: