题目内容
中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为
1:4.请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在元素周期表中的位置是
②含amolX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量是
(5)若A、B、X、Y均为化合物,A的焰色为黄色,向B溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀,若A和B按物质的量之比1:1反应则产生白色沉淀,A的化学式为 .
1:4.请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在元素周期表中的位置是
②含amolX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量是
(5)若A、B、X、Y均为化合物,A的焰色为黄色,向B溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀,若A和B按物质的量之比1:1反应则产生白色沉淀,A的化学式为
考点:无机物的推断
专题:推断题
分析:(1)若Y是黄绿色气体,在Y为氯气,A、B的物质的量之比为1:4,该反应为二氧化锰与浓盐酸制备氯气;
(2)若A为常见的非金属单质,B的溶液为某浓酸,A、B的物质的量之比为1:4,该反应为碳与浓硝酸反应,氧化产物为二氧化碳;
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,判断为铜和浓硫酸加热反应生成二氧化硫气体;
(4)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水;
(5)若A、B、X、Y均为化合物,A的焰色为黄色说明含有钠元素,向B溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀说明B中含有Cl-,若A和B按物质的量之比1:1反应则产生白色沉淀,说明B为HCl.
(2)若A为常见的非金属单质,B的溶液为某浓酸,A、B的物质的量之比为1:4,该反应为碳与浓硝酸反应,氧化产物为二氧化碳;
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,判断为铜和浓硫酸加热反应生成二氧化硫气体;
(4)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水;
(5)若A、B、X、Y均为化合物,A的焰色为黄色说明含有钠元素,向B溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀说明B中含有Cl-,若A和B按物质的量之比1:1反应则产生白色沉淀,说明B为HCl.
解答:
解:(1)若Y是黄绿色气体,在Y为氯气,A、B的物质的量之比为1:4,该反应为二氧化锰与浓盐酸制备氯气,反应离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,氯化氢在反应中做还原剂和酸,显示了还原性和酸性;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;还原性和酸性;
(2)若A为常见的非金属单质,B的溶液为某浓酸,A、B的物质的量之比为1:4,该反应为碳与浓硝酸反应,氧化产物为二氧化碳,C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,为铜和浓硫酸加热反应生成二氧化硫气体,Cu+2H2SO4
CuSO4+SO2↑+2H2O,
反应中氧化剂与还原剂的物质的量之比为1;1;
故答案为:1;1;
(4)①若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水,A元素在元素周期表中的位置是第四周期第ⅤⅢ族;
故答案为:第四周期第ⅤⅢ族;
②设被还原的硝酸铁的物质的量是xmol,则:
2Fe3++Fe=3Fe2+
2 3
x mol 1.5x mol
所以a-x=1.5x,解得x=0.4a,
故答案为:0.4a;
(5)若A、B、X、Y均为化合物,A的焰色为黄色说明含有钠元素,向B溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀说明B中含有Cl-,若A和B按物质的量之比1:1反应则产生白色沉淀,说明B为HCl,A为NaAlO2,反应为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
故答案为:NaAlO2.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)若A为常见的非金属单质,B的溶液为某浓酸,A、B的物质的量之比为1:4,该反应为碳与浓硝酸反应,氧化产物为二氧化碳,C+4HNO3(浓)
| ||
故答案为:C+4HNO3(浓)
| ||
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,为铜和浓硫酸加热反应生成二氧化硫气体,Cu+2H2SO4
| ||
反应中氧化剂与还原剂的物质的量之比为1;1;
故答案为:1;1;
(4)①若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水,A元素在元素周期表中的位置是第四周期第ⅤⅢ族;
故答案为:第四周期第ⅤⅢ族;
②设被还原的硝酸铁的物质的量是xmol,则:
2Fe3++Fe=3Fe2+
2 3
x mol 1.5x mol
所以a-x=1.5x,解得x=0.4a,
故答案为:0.4a;
(5)若A、B、X、Y均为化合物,A的焰色为黄色说明含有钠元素,向B溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀说明B中含有Cl-,若A和B按物质的量之比1:1反应则产生白色沉淀,说明B为HCl,A为NaAlO2,反应为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
故答案为:NaAlO2.
点评:本题考查无机物推断、离子方程式和结构式书写、根据方程式的计算等,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
相关题目
已知:C(s,金刚石)=C(s,石墨)△H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g)△H1
C(s,石墨)+O2(g)=CO2(g)△H2
根据已述反应所得出的结论正确的是( )
C(s,金刚石)+O2(g)=CO2(g)△H1
C(s,石墨)+O2(g)=CO2(g)△H2
根据已述反应所得出的结论正确的是( )
| A、△H1=△H2 |
| B、△H1>△H2 |
| C、△H1<△H2 |
| D、金刚石比石墨稳定 |
FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
| A、都呈透明的红褐色 |
| B、分散质颗粒直径相同 |
| C、都比较稳定,密封保存一段时间都不会产生沉淀 |
| D、都能产生丁达尔现象 |
下列化学用语表述正确的是( )
| A、碳酸溶于水的电离方程式:H2CO3?CO32-+2H+ |
| B、标准状况下将112mL Cl2通入10 mL 1 mol?L-1 FeBr2溶液的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
C、用单线桥表示浓盐酸和KClO3反应的电子转移的数目与方向: |
D、过氧化钠的电子式为: |
向溶液X中持续通人气体Y,会产生“澄清一浑浊一澄清”现象的是( )
| A、X:漂白粉溶液 Y:二氧化硫 |
| B、X:硝酸钡溶液 Y:二氧化硫 |
| C、X:氯化铝溶液 Y:氨气 |
| D、X:偏铝酸钠溶液 Y:二氧化氮 |
已知NaHSO4、MgS、MgSO4组成的混合物中,硫元素的质量分数为48%,则混合物中氧元素的质量分数为( )
| A、16% | B、25% |
| C、50% | D、无法确定 |
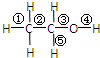 乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.
乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.