题目内容
5.某研究小组按下列路线合成镇痛药哌替啶: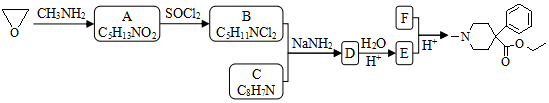
已知RX$\stackrel{NaCN}{→}$RCN$→_{H+}^{H_{2}O}$RCOOH
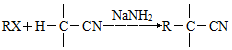
请回答:
(1)A→B的反应类型是取代反应.
(2)下列说法不正确的是A.
A.化合物A的官能团是硝基 B.化合物B可发生消去反应
C.化合物E能发生加成反应 D.哌替啶的分子式是C15H21NO2
(3)写出B+C→D的化学反应方程式
 .
.(4)设计以甲苯为原料制备C的合成路线(用流程图表示,无机试剂任选)
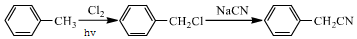 .
.(5)写出同时符合下列条件的C的所有同分异构体的结构简式
 .
.①分子中有苯环而且是苯环的邻位二取代物;
②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N).
分析 B与D发生信息中的反应生成D,D中含有-CN,D发生水解反应生成E,E中含有-COOH,结合E、F在酸性条件下生成物的结构简式,可知E、F发生酯化反应,结合B、C含有碳原子数目可推知F为CH3CH2OH、E为 ,结合有机物分子式逆推可知D为
,结合有机物分子式逆推可知D为 、C为
、C为 、B为
、B为 、A为
、A为 .
.
解答 解:B与D发生信息中的反应生成D,D中含有-CN,D发生水解反应生成E,E中含有-COOH,结合E、F在酸性条件下生成物的结构简式,可知E、F发生酯化反应,结合B、C含有碳原子数目可推知F为CH3CH2OH、E为 ,结合有机物分子式逆推可知D为
,结合有机物分子式逆推可知D为 、C为
、C为 、B为
、B为 、A为
、A为 .
.
(1)A→B是 发生取代反应生成
发生取代反应生成 ,
,
故答案为:取代反应;
(2)A.化合物A为 ,不含硝基,故A错误;
,不含硝基,故A错误;
B.化合物B为 ,可发生消去反应,故B正确;
,可发生消去反应,故B正确;
C.化合物E为 ,含有苯环,可以与氢气发生加成反应,故C正确;
,含有苯环,可以与氢气发生加成反应,故C正确;
D.由哌替啶的结构简式,可知其分子式是C15H21NO2,故D正确.
故选:A;
(3)B+C→D的化学反应方程式为: ,
,
故答案为: ;
;
(4)以甲苯为原料制备C( )的合成路线流程图为:
)的合成路线流程图为: ,
,
故答案为: ;
;
(5)C( )的同分异构体符合:①分子中有苯环而且是苯环的邻位二取代物;②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N),可能的同分异构体有:
)的同分异构体符合:①分子中有苯环而且是苯环的邻位二取代物;②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N),可能的同分异构体有: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,侧重考查学生自学能力、分析推理能力,充分利用哌替啶的结构简式、有机物分子式进行推断,(5)中同分异构体的书写为易错点、难点.

练习册系列答案
相关题目
14.短周期元素X、Y、Z、W的原子半径依次增大,其简单氢化物中X、Y、Z、W的化合价如表所示:
下列说法正确的是( )
| 元素 | X | Y | Z | W |
| 化合价 | -1 | -2 | -2 | -3 |
| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 元素的非金属性:X>Y | |
| C. | 氢化物的沸点:Z>Y | |
| D. | 元素Y不存在同素异形现象 |
16.有机物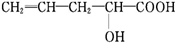 在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
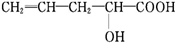 在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )| A. | ①④⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②③④ |
13.下列实验过程中,始终无明显现象的是( )
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | 乙烯通入溴的CCl4溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
20.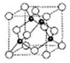 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
(1)基态E原子的核外电子排布式为1s22s22p63s23p63d54s1;基态D原子核外电子占据的能量最高的能级符号为3p.
(2)A元素的各级电离能如表:
分析表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是硼原子失去第3个电子后,达到稳定结构,不易再失去电子.
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是B、C、N的非金属性依次增强或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2.
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是NC13(填分子式).
(5)(DC)4为热色性固体,且有色温效应.低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色.在淡黄色→橙黄色→深红色的转化中,破坏的作用力是分子间作用力;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是共价键.在B、C、D的简单气态氢化物中,属于非极性分子的是CH4(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是NH3.
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示.已知:该晶体密度为ρg•cm-3,NA代表阿伏伽德罗常数的值.
①该晶体的化学式为BN.
②在该晶体中,A与C形成共价键的键长(d)为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 pm.
 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.(1)基态E原子的核外电子排布式为1s22s22p63s23p63d54s1;基态D原子核外电子占据的能量最高的能级符号为3p.
(2)A元素的各级电离能如表:
| 能级(I) | I1 | I2 | I3 | I4 | I5 |
| 电离能/kJ•mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是B、C、N的非金属性依次增强或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2.
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是NC13(填分子式).
(5)(DC)4为热色性固体,且有色温效应.低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色.在淡黄色→橙黄色→深红色的转化中,破坏的作用力是分子间作用力;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是共价键.在B、C、D的简单气态氢化物中,属于非极性分子的是CH4(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是NH3.
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示.已知:该晶体密度为ρg•cm-3,NA代表阿伏伽德罗常数的值.
①该晶体的化学式为BN.
②在该晶体中,A与C形成共价键的键长(d)为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 pm.
10.表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 盛放氢氧化钠溶液的试剂瓶用橡胶塞 | 氢氧化钠可以与玻璃中的二氧化硅反应生成粘性的硅酸钠 | Ⅰ对,Ⅱ错,无 |
| B | 氯水可以使有色布条褪色 | 氯气具有漂白性 | Ⅰ错,Ⅱ对,有 |
| C | 二氧化硅可以与水反应生成硅酸 | 二氧化硅是酸性氧化物具有酸性氧化物的通性 | Ⅰ对,Ⅱ对,无 |
| D | 为增强漂白能力使用漂白粉时向漂白粉溶液中加入少量白醋 | 醋酸的酸性比次氯酸强 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
14.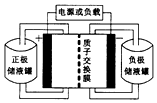 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )
 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )| A. | VCl2存储在正极储液罐内 | |
| B. | 放电时H+从负极区移至正极区 | |
| C. | 充电时电池的负极与电源的正极相连 | |
| D. | 充电时阳极反应为Br-+2Cl--2e-═BrCl2- |
15.在加热条件下,乙醇转化为有机物R的过程如图所示,其中错误的是( )
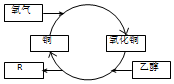

| A. | R的化学式为C2H4O | |
| B. | 乙醇发生了还原反应 | |
| C. | 反应过程中固体有红黑交替变化的现象 | |
| D. | 乙二醇(HO-CH2-CH2-OH)也能发生类似反应 |
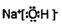 .
.