题目内容
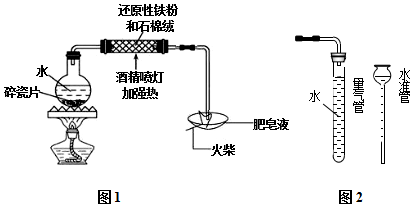
14.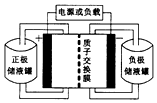 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )| A. | VCl2存储在正极储液罐内 | |
| B. | 放电时H+从负极区移至正极区 | |
| C. | 充电时电池的负极与电源的正极相连 | |
| D. | 充电时阳极反应为Br-+2Cl--2e-═BrCl2- |
分析 电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-,则VCl2在反应中失电子,在负极上反应,在BrCl2-正极上得电子,充电时,阴极与负极、阳极与正极互为可逆反应,据此分析.
解答 解:A.由反应的总方程式可知,VCl2在反应中失电子,在负极上反应,存储在负极储液罐内,故A错误;
B.放电时,阳离子向正极移动,即放电时H+从负极区移至正极区,故B正确;
C.充电时电池的负极与电源的负极相连,故C错误;
D.充电时阳极上发生失电子的氧化反应,则充电时阳极反应为Br-+2Cl--2e-═BrCl2-,故D正确.
故选BD.
点评 本题考查了原电池和电解池,会根据得失电子判断原电池正负极和电解池阴阳极,知道充电电池中原电池正负极发生的电极反应式是电解池阳极、阴极电极反应式的逆反应,难度中等.

练习册系列答案
相关题目
4.甲、乙两个烧瓶收集等量的NO2气体并密封,又知2NO2?N2O4△H<0,将甲置于热水中,乙置于冷水中.下列有关现象描述中正确的是( )
| A. | 甲颜色加深 | B. | 乙颜色加深 | C. | 甲、乙颜色都加深 | D. | 甲、乙颜色都变浅 |
2.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | 氯化铵的电子式: [H [H H]+Cl- H]+Cl- | |
| C. | 原子核内有10个中子的氧原子:188O | |
| D. | 用电子式表示水的形成过程:H×+ +×H→ +×H→ |
6.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| B. | 28g乙烯和环丙烷(C3H6)组成的混合气体,完全燃烧时,转移的电子数为12NA | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中,所含NH4+数小于0.2NA | |
| D. | 标准状况下,2.24 L18O2中含有2NA个中子 |
3.化学在生产、生活中有着广泛的应用,下列叙述不合理的是( )
| A. | 晶体硅熔点高,可制玻璃仪器 | B. | NaHCO3受热分解,可焙制糕点 | ||
| C. | N2化学性质稳定,可作保护气 | D. | 明矾易水解生成胶体,可作净水剂 |


 .
. .
. .
.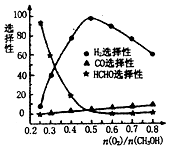 碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题: