题目内容
17.下列有关Fe、Cu及其化合物的说法中,不正确的是( )| A. | Fe、Cu元素在白然界中主要以化合态形式存在 | |
| B. | CO在高温下能将Fe203还原为Fe | |
| C. | Fe与盐酸、Fe与Cl2发生反应均生成FeCl3 | |
| D. | 制作印刷电路板时,可用FeCl3溶液腐蚀Cu |
分析 A、铁是活泼金属易和空气中氧气,水蒸气等物质发生反应;
B、一氧化碳还原氧化铁为铁;
C、铁和盐酸反应生成氯化亚铁和氢气;
D、氯化铁和铜反应,能溶解线路板上的铜为氯化铜;
解答 解:A、铁铜是金属,易和空气中氧气,水蒸气等物质发生反应,生成氧化物,自然界中主要是化合态,故A正确;
B、一氧化碳还原氧化铁为铁,是工业冶炼铁的原理,故B正确;
C、铁和盐酸反应生成氯化亚铁和氢气,Fe与Cl2发生反应生成FeCl3,故C错误;
D、氯化铁和铜反应,能溶解线路板上的铜为氯化铜,可以制备印刷电路板,故D正确;
故选C.
点评 本题考查了金属性质和存在,物质性质的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)?C8H8(g)+H2(g)△H>0
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
(1)当反应进行到20min时,该段时间内H2的平均反应速率是0.0035mol/(L•min).
(2)该温度下,该反应的化学平衡常数是0.053.
(3)已知:
计算上述反应的△H=125 kJ•mol-1.若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.此时,该反应是否达到了平衡状态?是(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.

(4)由图Ⅰ可知,T1大于T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将越大(填“越大”、“越小”或“不变”),原因是水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是0.053.
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412.5 | 348 | 612 | 436 |
计算上述反应的△H=125 kJ•mol-1.若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是60%.此时,该反应是否达到了平衡状态?是(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.

(4)由图Ⅰ可知,T1大于T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将越大(填“越大”、“越小”或“不变”),原因是水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
8.关于下列装置说法正确的是( )
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 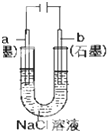 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 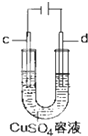 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
5. 在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
 在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )| A. | 在t5时,容器NO2的体积分数是整个过程中的最大值 | |
| B. | 在t2时,采取的措施可以是增大压强 | |
| C. | 在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态 | |
| D. | 在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态 |
12.下列四组混合气体(体积比)为①NO2:O2=1:1 ②NO:O2=1:1 ③NH3:O2=1:1④NO2:NO:O2=1:1:1,将分别盛满上述各种气体的容积相等的四支试管倒置于盛有水的水槽中,最后试管内液面由低到高顺序正确的是( )
| A. | ④③②① | B. | ④①②③ | C. | ①③②④ | D. | ③①②④ |
2.在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法错误的是( )

| A. | 标准状况下当甲中产生4.48 L气体时,丙中Cu电极质量增加21.6g | |
| B. | 电解过程中丙中溶液pH无变化 | |
| C. | 向甲中加入适量的盐酸,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-═Cu |
18.已知氯化银、溴化银的溶解度分别是1.5×10-4g和8.4×10-6g,将氯化银和溴化银的饱和溶液等体积混合,再加入足量浓硝酸银溶液,则发生的反应为( )
| A. | 只有溴化银沉淀生成 | B. | 氯化银河溴化银沉淀等量生成 | ||
| C. | 氯化银沉淀多于溴化银沉淀 | D. | 氯化银沉淀少于溴化银沉淀 |

