题目内容
8.关于下列装置说法正确的是( )| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 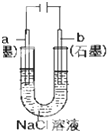 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 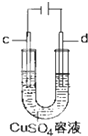 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
分析 A、Zn为负极,盐桥中的阳离子移向正极;
B、a为阴极,氢离子在a极放电,氢氧根离子浓度增大;
C、c为阴极,发生还原反应;
D、该装置是原电池,锌比铁活泼,所以锌为负极失电子发生氧化反应.
解答 解:A、盐桥中的钾离子移向正极硫酸铜溶液,故A错误;
B、氢离子在阴极放电,生成氢氧根离子,故B正确;
C、c为阴极,发生还原反应,故C错误;
D、该装置是原电池,锌比铁活泼,所以锌为负极失电子发生氧化反应,则电子由Zn流向Fe,装置中有Zn2+生成,故D错误;
故选B.
点评 本题通过图象考查了盐桥中离子移动方向、电解NaCl溶液时的电极反应等原电池、电解池的原理,题目难度不大.

练习册系列答案
相关题目
19.常温下,下列各组离子中,在给定条件下一定能够大量共存的是( )
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 滴加紫色石蕊溶液显红色的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、SO42-、NO3- |
3.将一定量的氯气通入50mL 10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为9﹕5 | |
| C. | 若反应中转移的电子为n mol,则0.20<n<0.30 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
13.下列说法正确的是( )
| A. | SiH4比CH4稳定 | |
| B. | O2- 半径比F- 的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | P和S属于第三周期的元素,H3PO4酸性比H2SO4的弱 |
20.低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题. 已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:
请回答下列问题:
(1)上述正反应方向是放热反应(填“放热”或“吸热”).
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图1,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
t1℃时物质浓度(mol/L)的变化
(3)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为X=Y
(4)t1(℃高于850)℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于平衡状态;理由是反应在3min和4min时的各物质浓度相同.
②表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为75%.
(6)若在500℃时该反应达到了平衡状态,此时体系中的v-t图象如图2所示,若在t1时给体系适当升高温度,则v-t图象也会随之发生变化,请把v-t图补充画全(需标明正方向的反应速率和逆方向的反应速率).

| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
(1)上述正反应方向是放热反应(填“放热”或“吸热”).
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图1,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(4)t1(℃高于850)℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于平衡状态;理由是反应在3min和4min时的各物质浓度相同.
②表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为75%.
(6)若在500℃时该反应达到了平衡状态,此时体系中的v-t图象如图2所示,若在t1时给体系适当升高温度,则v-t图象也会随之发生变化,请把v-t图补充画全(需标明正方向的反应速率和逆方向的反应速率).

17.下列有关Fe、Cu及其化合物的说法中,不正确的是( )
| A. | Fe、Cu元素在白然界中主要以化合态形式存在 | |
| B. | CO在高温下能将Fe203还原为Fe | |
| C. | Fe与盐酸、Fe与Cl2发生反应均生成FeCl3 | |
| D. | 制作印刷电路板时,可用FeCl3溶液腐蚀Cu |
 氨的合成是目前普遍使用的人工固氮方法.
氨的合成是目前普遍使用的人工固氮方法.