题目内容
在电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
| A、将盐酸逐滴加入食盐溶液 |
| B、将硫酸逐滴加入氢氧化钡溶液 |
| C、将硫酸逐滴加入氢氧化钠溶液 |
| D、将醋酸逐滴加入氨水(NH3?H2O为弱电解质,CH3COONH4为强电解质) |
考点:电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,说明溶液中电解质的浓度降低,说明所加入物质能与溶液中电解质反应生成弱电解质或沉淀,至熄灭后又逐渐变亮,说明完全反应时溶液电荷浓度接近0,当另一溶液过量时,溶液中电荷浓度逐渐增大,又逐渐变亮.
解答:
解:A.将盐酸逐滴加入食盐溶液,溶液电荷浓度不为0,灯泡不可能熄灭,故A错误;
B.将硫酸逐滴加入氢氧化钡溶液,完全反应时生成硫酸钡和水,溶液电荷浓度接近0,灯泡熄灭,符合题目要求,故B正确;
C.将硫酸逐滴加入氢氧化钠溶液,反应生成硫酸钠,溶液电荷浓度不为0,灯泡不可能熄灭,故C错误;
D.醋酸中逐滴加入氨水,生成醋酸铵,溶液电荷浓度不为0,灯泡不可能熄灭,故D错误.
故选B.
B.将硫酸逐滴加入氢氧化钡溶液,完全反应时生成硫酸钡和水,溶液电荷浓度接近0,灯泡熄灭,符合题目要求,故B正确;
C.将硫酸逐滴加入氢氧化钠溶液,反应生成硫酸钠,溶液电荷浓度不为0,灯泡不可能熄灭,故C错误;
D.醋酸中逐滴加入氨水,生成醋酸铵,溶液电荷浓度不为0,灯泡不可能熄灭,故D错误.
故选B.
点评:本题考查电解质溶液的导电性,题目难度不大,注意灯泡熄灭,说明完全反应时溶液电荷浓度接近0,根据反应物进行判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
合理使用食品添加剂,可以使食物色、香、味俱全.下列食品添加剂中,属于发色剂的是( )
| A、番茄红素 | B、谷氨酸钠 |
| C、亚硝酸钠 | D、柠檬黄 |
化学式为C4H8的链状烃有(考虑顺反异构体)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
Na2HPO4溶液中存在着下列电离平衡:HPO42-?H++PO43-,要使溶液中[HPO42-]、[H+]、[PO43-]均减小可采用的方法是( )
| A、加盐酸 | B、加生石灰 |
| C、加热 | D、用水稀释 |
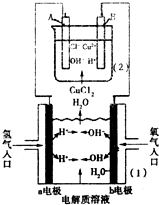 如图所示为某实验小组用氢气--氧气燃料电池[装置(1)]电解氯化铜溶液[装置(2)]构造原理图.下列有关说法错误的是( )
如图所示为某实验小组用氢气--氧气燃料电池[装置(1)]电解氯化铜溶液[装置(2)]构造原理图.下列有关说法错误的是( )| A、若(1)池中使用的电解质溶液为NaOH溶液,则a极发生氧化反应 | ||||
| B、若(1)池中使用的电解质溶液为稀硫酸,则b极的电极反应式为2H2O+O2+4e-═4OH- | ||||
C、若(2)池中A、B均为石墨电极,则(2)池中发生反应离子方程式为Cu2++2Cl-
| ||||
| D、若(2)池中A、B均为石墨电极,当A极增重3.2g时,理论上a极将消耗H2 1120mL(标况) |
下列说法正确的是( )
| A、28gN2所含有的原子数为Na |
| B、0.1molNH3所含有的电子数为0.4NA |
| C、在标准状况下,22.4L水的质量约为18g |
| D、22gCO2在标准状况下与11.2L氯化氢含有相同的分子数 |
组成为C4H9Cl的卤代烃,可能存在的同分异构体有( )
| A、三种 | B、四种 | C、五种 | D、六种 |
密闭容器中发生如下反应:N2(g)+3H2(g)?2NH3(g) 已知反应过程中某时刻N2、H2、NH3的浓度分别为0.8mol/L、0.6mol/L、0.2mol/L.在一定条件下达平衡时各物质的浓度可能是( )
| A、N2为0.7mol/L |
| B、H2为0.9mol/L |
| C、NH3为0.6mol/L |
| D、H2、NH3均为0.5mol/L |