题目内容
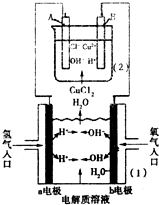 如图所示为某实验小组用氢气--氧气燃料电池[装置(1)]电解氯化铜溶液[装置(2)]构造原理图.下列有关说法错误的是( )
如图所示为某实验小组用氢气--氧气燃料电池[装置(1)]电解氯化铜溶液[装置(2)]构造原理图.下列有关说法错误的是( )| A、若(1)池中使用的电解质溶液为NaOH溶液,则a极发生氧化反应 | ||||
| B、若(1)池中使用的电解质溶液为稀硫酸,则b极的电极反应式为2H2O+O2+4e-═4OH- | ||||
C、若(2)池中A、B均为石墨电极,则(2)池中发生反应离子方程式为Cu2++2Cl-
| ||||
| D、若(2)池中A、B均为石墨电极,当A极增重3.2g时,理论上a极将消耗H2 1120mL(标况) |
考点:电解原理
专题:电化学专题
分析:A、燃料电池的负极上是燃料发生失电子的氧化反应;
B、燃料电池的正极上是氧气发生得电子的还原反应,根据电解质环境书写电极反应式;
C、根据电解池的工作原理来书写电极方程式;
D、根据电解池的工作原理以及电子守恒计算消耗氢气的量.
B、燃料电池的正极上是氧气发生得电子的还原反应,根据电解质环境书写电极反应式;
C、根据电解池的工作原理来书写电极方程式;
D、根据电解池的工作原理以及电子守恒计算消耗氢气的量.
解答:
解:A、氢氧燃料电池的负极上是燃料氢气发生失电子的氧化反应,即a极发生氧化反应,故A正确;
B、氢氧燃料电池的正极上是氧气发生得电子的还原反应,在酸性电解质下,电极反应为:O2+4e-+4H+=2H2O,故B错误;
C、以石墨电极为电极,电解氯化铜溶液的离子方程式为Cu2++2Cl-
Cu+Cl2↑,故C正确;
D、(2)池中A、B均为石墨电极,当A极增重3.2g即0.05mol时,根据电极反应Cu2++2e-=Cu,转移电子是0.1mol,在a极将消耗H20.05mol即1120mL(标况),故D正确.
故选B.
B、氢氧燃料电池的正极上是氧气发生得电子的还原反应,在酸性电解质下,电极反应为:O2+4e-+4H+=2H2O,故B错误;
C、以石墨电极为电极,电解氯化铜溶液的离子方程式为Cu2++2Cl-
| ||
D、(2)池中A、B均为石墨电极,当A极增重3.2g即0.05mol时,根据电极反应Cu2++2e-=Cu,转移电子是0.1mol,在a极将消耗H20.05mol即1120mL(标况),故D正确.
故选B.
点评:本题涉及燃料电池以及电解池的工作原理和应用知识,注意电子守恒知识在解题中的应用是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
不能用H++OH-═H2O表示的离子反应的是( )
| A、氢氧化钠溶液和硫酸氢钠溶液 |
| B、氢氧化钡和硫酸溶液 |
| C、硫酸氢铵溶液和少量氢氧化钠溶液 |
| D、石灰水和硝酸溶液 |
把铝粉和某铁的氧化物xFeO?yFe2O3粉末配成铝热剂,分成两等份.一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放人足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是5:7,则x:y为( )
| A、1:2 | B、1:1 |
| C、5:7 | D、7:5 |
在电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
| A、将盐酸逐滴加入食盐溶液 |
| B、将硫酸逐滴加入氢氧化钡溶液 |
| C、将硫酸逐滴加入氢氧化钠溶液 |
| D、将醋酸逐滴加入氨水(NH3?H2O为弱电解质,CH3COONH4为强电解质) |
若用CuSO4?5H2O晶体配制450mL 0.2mol/L 的CuSO4溶液,需要CuSO4?5H2O晶体的质量为( )
| A、25g | B、16g |
| C、9g | D、22.5g |
下列关于NaHCO3和Na2CO3的说法中,正确的是( )
| A、NaHCO3的热稳定性比Na2CO3的热稳定强 |
| B、可以用加热的方法除去Na2CO3溶液中混有的少量NaHCO3 |
| C、NaHCO3比Na2CO3容易溶于水 |
| D、NaHCO3既能与盐酸发生反应,又能与NaOH溶液发生反应 |
下列实验操作错误的是( )
| A、蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口附近 |
| B、不能用酒精萃取碘水中的碘 |
| C、配置一定物质的量浓度的溶液,向容量瓶加水至液面离刻度线1-2cm时,改用胶头滴管定容 |
| D、用铂丝蘸取某溶液至于酒精灯火焰上灼烧,直接观察火焰颜色,检验K+的存在 |
下列图示与对应的叙述相符的是( )

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(S)的影响,甲的压强比乙的压强大 |
| C、图3表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A |
| D、图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |