题目内容
11.下面三个方法都可以用来制氯气:①4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$ nCl2+Cl2↑+2H2O
②4HCl(g)+O2 $\frac{\underline{\;催化剂\;}}{△}$2Cl2+2H2O(g)
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂氧化性由强到弱的顺序是( )
| A. | O2 MnO2 KMnO4 | B. | KMnO4 MnO2O2 | ||
| C. | MnO2KMnO4 O2 | D. | O2 KMnO4 MnO2 |
分析 根据反应条件判断反应的难易程度,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,据此分析解答.
解答 解:根据方程式①4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、②4HCl(g)+O2$\frac{\underline{催化剂}}{△}$2Cl2+2H2O(g)、③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O知,③没有反应条件,①的反应条件是加热,②的反应条件是加热和催化剂,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,所以氧化性最强的是高锰酸钾,其次是二氧化锰,最后是氧气,
故选B.
点评 本题考查了氧化剂氧化性强弱的判断,根据“反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强”来解答即可,难度不大.

练习册系列答案
相关题目
1.某温度时,在一体积不变的容器中充入A、B各1mol,反应进行到10s时,测得容器中含有A:0.8mol;B:0.4mol;C:0.4mol.据此回答该反应的化学方程式为( )
| A. | A+3B═C | B. | 2A+B═C | C. | A+3B═2C | D. | A+3B═3C |
19.将过氧化钠投入FeCl2溶液中,可观察到的实验现象是( )
| A. | 有白色沉淀生成 | B. | 没有沉淀生成 | ||
| C. | 有红褐色沉淀生成 | D. | 有无色气体产生 |
16.将过量SO2通入下列溶液中,能出现白色浑浊的是( )
①Ca(OH)2;
②BaCl2;
③NaAlO2;
④Na2SiO3;
⑤Ba(NO3)2;
⑥苯酚钠;
⑦Na2CO3.
①Ca(OH)2;
②BaCl2;
③NaAlO2;
④Na2SiO3;
⑤Ba(NO3)2;
⑥苯酚钠;
⑦Na2CO3.
| A. | ①②④⑦ | B. | ②③⑥⑦ | C. | ④⑤⑥⑦ | D. | ④⑤⑥ |
3.根据硫元素的原子结构,推测硫元素的最高正价和最低负价分别为( )
| A. | +2、-2 | B. | +6、-2 | C. | +4、-4 | D. | +2、-6 |
 锰及其化合物有广泛应用.
锰及其化合物有广泛应用.
 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$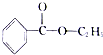 +H2O.
+H2O.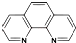 ),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.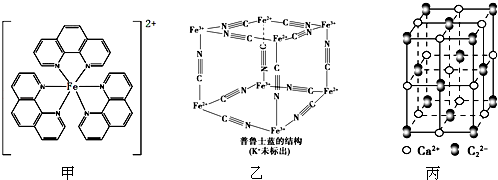
 ,其中σ键与π键数目之比为1:2.
,其中σ键与π键数目之比为1:2.