题目内容
3.在标准状况下:a.6.72LCH4气体b.3.01×1023个HCl气体分子
c.13.6gH2S气体
d.0.2molNH3
下列对这四种气体的关系从大到小的排列是(用上述序号表示).
①四种气体的物质的量b>c>a>d;
②标准状况下四种气体的密度b>c>d>a.
分析 ①n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$;
②相同条件下气体摩尔体积相等,标况下气体密度=$\frac{M}{{V}_{m}}$,根据公式知,气体密度与摩尔质量成正比.
解答 解:①n(CH4)=$\frac{V}{{V}_{m}}$=$\frac{6.72L}{22.4L/mol}$=0.3mol,
n(HCl)=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,
n(H2S)=$\frac{m}{M}$=$\frac{13.6g}{34g/mol}$=0.4mol;
n(NH3)=0.2mol;
所以这四种气体的物质的量大小顺序是b>c>a>d,故答案为:b>c>a>d;
②相同条件下气体摩尔体积相等,标况下气体密度=$\frac{M}{{V}_{m}}$,根据公式知,气体密度与摩尔质量成正比,甲烷的摩尔质量是16g/mol、HCl的摩尔质量是36.5g/mol、硫化氢的摩尔质量是34g/mol、氨气的摩尔质量是17g/mol,则这四种气体密度大小顺序是b>c>d>a,故答案为:b>c>d>a.
点评 本题考查物质的量的有关计算,为高频考点,明确各个物理量之间的关系是解本题关键,注意密度与摩尔质量的关系,为易错点,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案
相关题目
7.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| C. | 除去苯中的少量苯酚的方法:加入适量溴水,过滤 | |
| D. |  如图中有机物的一氯代物有5种 如图中有机物的一氯代物有5种 |
11.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 现有乙烯.丙烯.丁烯的混合气体共14g,其原子数为3NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为7NA | |
| D. | 28g乙烯所含共用电子对数目为4NA |
18.某有机物的结构简式为 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )
①加成反应 ②消去反应 ③水解反应 ④酯化反应 ⑤氧化反应 ⑥加聚反应.
 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )①加成反应 ②消去反应 ③水解反应 ④酯化反应 ⑤氧化反应 ⑥加聚反应.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑤⑥ |
8.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 银镜反应实验后试管内壁附有银,可用氨水清洗 | |
| C. | 为除去苯中少量的苯酚,可加入足量浓溴水后过滤 | |
| D. | 为除去乙酸乙酯中少量的乙酸,可用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 |
15.表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素是Ar.(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是Na>Mg>F (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程 .
.
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的NaOH.(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2(填化学式).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)②③④三种元素的原子半径从大到小的顺序是Na>Mg>F (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程
 .
.(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的NaOH.(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2(填化学式).
12.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )


| A. | 和金属钠作用时,键①断裂 | |
| B. | 乙醇燃烧时所有键断裂 | |
| C. | 和乙酸、浓硫酸共热制乙酸乙酯时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
13.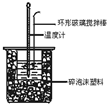 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )| A. | 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
