题目内容
1.常温下,向明矾溶液中滴入Ba(OH)2溶液至SO42-刚好完全沉淀时,溶液pH>7,(用“>、<、=”符号填空)反应的离子方程式为Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O.分析 设Ba(OH)2的物质的量为1mol,水溶液中Ba2+恰好沉淀时,需硫酸根离子1mol,所以明矾与Ba(OH)2的物质的量之比为1:2,进而书写反应的离子方程式,并判断溶液的酸碱性.
解答 解:假设Ba(OH)2的物质的量为1mol,水溶液中Ba2+恰好沉淀时,需硫酸根离子1mol,所以明矾与Ba(OH)2的物质的量之比为1:2,反应的离子反应为:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,由于偏铝酸根离子部分水解,溶液呈碱性,溶液的pH>7,
故答案为:>;Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O.
点评 本题考查了离子方程式书写、溶液酸碱性判断,题目难度中等,明确发生反应的实质为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
11.下列有关应用中,不科学的是( )
| A. | 用铝丝作高压电缆 | B. | 用不锈钢碗存放食醋 | ||
| C. | 用铝槽车运输浓硫酸 | D. | 用硬铝作制航天器的材料 |
12. 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1 mol该物质可与5 mol NaOH发生反应 | |
| B. | 1 mol该物质与足量浓溴水反应,最多消耗6 mol Br2 | |
| C. | 一定条件下1 mol该物质可与H2加成,消耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
9.在分析某些溶液中的离子成分时,为了排除其他离子可能的干扰,通常先在溶液中加入一些试剂对干扰离子进行掩蔽以得到准确的结果.下列掩蔽方法和分析结果正确的是( )
| A. | 某溶液中滴加KSCN溶液呈无色,再滴加氯水后出现血红色,该溶液中含有Fe2+ | |
| B. | 某溶液中滴加NaOH溶液后再滴加CaCl2溶液出现白色沉淀,该溶液中含有CO32- | |
| C. | 某溶液中滴加氨水后再滴加NaOH溶液出现白色沉淀,该溶液中含有Al3+ | |
| D. | 某溶液中滴加足量稀盐酸后,再滴加BaCl2溶液才出现白色沉淀,该溶液中含有SO42- |
16.一定温度下,在一密闭容器中加入1molPCl5,发生反应PCl5(g)?PCl3(g)+Cl2 (g)充分反应平衡后,测得PCl5的分解率为a%,此时,再向密闭容器中加入1mol PCl5,充分反应,再次平衡后,下列有关说法正确的是( )
| A. | PCl5的分解率大于a% | |
| B. | PCl5的分解率小于a% | |
| C. | 达到平衡后正逆反应速率比原平衡状态时大 | |
| D. | 达到平衡后正逆反应速率比原平衡状态时小 |
17.一定温度下,将NO2与SO2以体积比为1:2置于密闭容器中发生NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
| A. | 平衡常数K=$\frac{8}{3}$ | |
| B. | 达到平衡后NO2和SO2的转化率相等 | |
| C. | SO3和NO的体积比保持不变可以证明达到平衡状态 | |
| D. | 每消耗1molSO3的同时生成1molNO2可以证明达到平衡状态 |
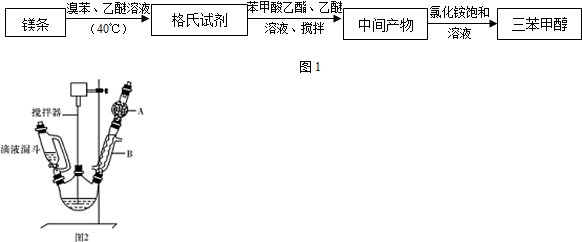
18.三苯甲醇(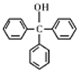 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
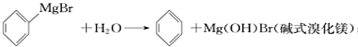
已知:(I)格氏试剂容易水解:
(Ⅱ)相关物质的物理性质如下:
(Ⅲ)三苯甲醇的相对分子质量是260.
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
已知:(I)格氏试剂容易水解:

(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
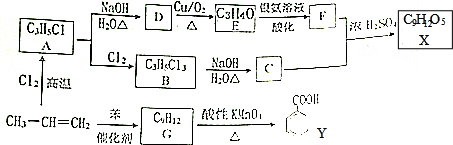
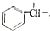 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$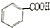
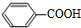 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$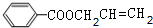 +H2O.
+H2O.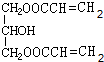 (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC.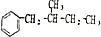 :则Z的同分异构体中,符合
:则Z的同分异构体中,符合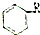 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z).