题目内容
“酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
| A、抑制Fe2+的水解,用稀硝酸酸化 |
| B、提高高锰酸钾的氧化能力,用盐酸酸化 |
| C、检验SO42-时,用盐酸酸化 |
| D、检验Cl-时,用稀硫酸酸化 |
考点:氧化还原反应,常见阴离子的检验
专题:物质检验鉴别题,氧化还原反应专题
分析:A.从硝酸有强氧化性的角度分析;
B.高锰酸钾在酸性条件下与氯离子发生氧化还原反应;
C.检验溶液中是否含有SO42-时,要防止SO32-、CO32-等离子对SO42-的干扰;
D.检验Cl-时,用稀硫酸酸化,再加硝酸银溶液.
B.高锰酸钾在酸性条件下与氯离子发生氧化还原反应;
C.检验溶液中是否含有SO42-时,要防止SO32-、CO32-等离子对SO42-的干扰;
D.检验Cl-时,用稀硫酸酸化,再加硝酸银溶液.
解答:
解:A.硝酸有强氧化性,能将Fe2+氧化为Fe3+,故A错误;
B.由于高锰酸钾具有强氧化性,可先将氯离子氧化为氯气,不能用盐酸酸化,故B错误;
C.检验溶液中是否含有SO42-时,先加盐酸酸化的目的是为了防止SO32-、CO32-等离子对SO42-的干扰,故C正确;
D.检验Cl-时,用硝酸酸化,然后加入硝酸银溶液观察是否有白色沉淀生成,硫酸银是微溶物质在溶液中会形成白色沉淀,而且若含有钡离子,加硫酸会生成硫酸钡沉淀,干扰氯离子的检验,不能用硫酸酸化,故D错误.
故选C.
B.由于高锰酸钾具有强氧化性,可先将氯离子氧化为氯气,不能用盐酸酸化,故B错误;
C.检验溶液中是否含有SO42-时,先加盐酸酸化的目的是为了防止SO32-、CO32-等离子对SO42-的干扰,故C正确;
D.检验Cl-时,用硝酸酸化,然后加入硝酸银溶液观察是否有白色沉淀生成,硫酸银是微溶物质在溶液中会形成白色沉淀,而且若含有钡离子,加硫酸会生成硫酸钡沉淀,干扰氯离子的检验,不能用硫酸酸化,故D错误.
故选C.
点评:本题考查了氧化还原反应的应用,主要涉及离子的检验、盐类水解等问题,题目难度中等,检验离子时注意要排除其他离子的干扰.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、已知甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、一定条件,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3 kJ,则其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| C、常温下反应C(s)+CO2(g)═2CO(g)不能自发进行是由于该反应△H>0 |
| D、已知25℃时,HCl(aq)和NaOH(aq)反应的中和热△H=-57.3 kJ?mol-1,则H2SO4(aq)和Ba(OH)2(aq)反应的中和热为△H=-114.6 kJ?mol-1 |
下来关于反应能量的说法正确的是( )
| A、Zn(s)+CuSO4 (aq)=ZnSO4 (aq)+Cu(s);△H=-216kJ?mol-1,反应物总能量>生成物总能量 |
| B、相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1=E2 |
| C、l0lkPa 时,2H2 (g)+O2 (g)=2H2O(1);△H=-571.6 kJ?mol-1,H2的燃烧热为571.6 kJ?mol' |
| D、H+ (aq)+OH-(aq)=H2O(l);△H=-57.3 kJ?mol-',含 1molNaOH 的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
下列说法或表示方法中正确的是( )
| A、化学变化的实质是旧键的断裂和新键的生成,有物质变化但不一定有能量变化 |
| B、氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=285.8kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和热为57.3kJ?mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ |
 ,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):
,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):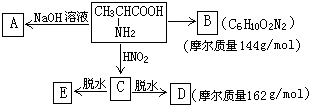
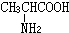 与
与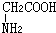 混合置于一反应容器中,一定条件下发生成肽反应,则最多生成
混合置于一反应容器中,一定条件下发生成肽反应,则最多生成