题目内容
下列说法或表示方法中正确的是( )
| A、化学变化的实质是旧键的断裂和新键的生成,有物质变化但不一定有能量变化 |
| B、氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=285.8kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和热为57.3kJ?mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、依据化学反应实质是旧键的断裂和新键的生成,有物质变化一定有能量变化;
B、燃烧热是1mol可燃性物质完全燃烧生成稳定氧化物放出的热量;
C、反应是吸热反应;
D、浓硫酸溶解溶液温度升高.
B、燃烧热是1mol可燃性物质完全燃烧生成稳定氧化物放出的热量;
C、反应是吸热反应;
D、浓硫酸溶解溶液温度升高.
解答:
解:A、依据化学反应实质是旧键的断裂和新键的生成,有物质变化,也一定伴随有能量变化,故A错误;
B、燃烧热是1mol可燃性物质完全燃烧生成稳定氧化物放出的热量,氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1,故B错误;
C、反应是吸热反应,故C错误;
D、浓硫酸溶解溶液温度升高,已知中和热为57.3kJ?mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ,故D正确.
故选D.
B、燃烧热是1mol可燃性物质完全燃烧生成稳定氧化物放出的热量,氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为:H2(g)+
| 1 |
| 2 |
C、反应是吸热反应,故C错误;
D、浓硫酸溶解溶液温度升高,已知中和热为57.3kJ?mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ,故D正确.
故选D.
点评:本题考查了化学反应能量变化,燃烧热、中和热概念的理解应用,注意理解反应实质是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述错误的是( )
| A、铜锌合金制成的假金元宝欺骗行人的事件屡有发生,可以把它放入硝酸中进行鉴别 |
| B、装饰材料中的甲醛、芳香烃及氡等会造成居室污染 |
| C、我国的酸雨主要是硫酸型酸雨、 |
| D、尼龙是一种有机高分子材料,耐酸碱腐蚀,不怕火烧 |
某温度时,N2+3H2
2NH3的平衡常数K=a,则此温度下,NH3
H2+
N2的平衡常数为( )
| 催化剂 |
| 催化剂 |
| 3 |
| 2 |
| 1 |
| 2 |
| A、a-1/2 | ||
B、
| ||
| C、a1/2 | ||
| D、a-2 |
如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是( )


| A、锌片为负极,且锌片逐渐溶解 |
| B、铜为正极,铜不易失电子而受到保护 |
| C、电子由铜片通过导线流向锌片 |
| D、该装置能将化学能转变为电能 |
“酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
| A、抑制Fe2+的水解,用稀硝酸酸化 |
| B、提高高锰酸钾的氧化能力,用盐酸酸化 |
| C、检验SO42-时,用盐酸酸化 |
| D、检验Cl-时,用稀硫酸酸化 |
下列中学常见化学反应中,既属于氧化还原反应又属于分解反应的是( )
| A、三氧化硫溶于水生成硫酸 |
| B、碳酸钙受热分解生成氧化钙和二氧化碳 |
| C、高锰酸钾受热发生反应制氧气 |
| D、过氧化钠中通入二氧化碳气体 |
下列物质中不属于有机物的是( )
| A、醋酸 | B、乙炔 | C、氯乙烷 | D、碳酸 |
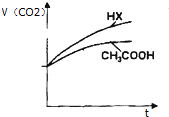 25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )
25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )| A、电离平衡常数:CH3COOH>HX>H2CO3 |
| B、将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c(H+)较大的为HX溶液 |
| C、往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,混合后的离子浓度大小关系为c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
| D、当浓度均为0.1mol?L-1的CH3COOH溶液和HX的混合液用标准氢氧化钠溶液滴定至中性时,CH3COOH被完全中和 |
 W、X、Y、Z四种短周期元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
W、X、Y、Z四种短周期元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: