题目内容
已知N2O4(g)?2NO2(g)△H<0,
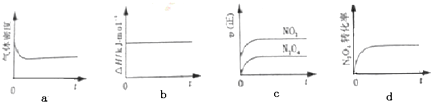
(1)现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”).反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)= mol?L-1?S-1.
(3)NO2可用氨水吸收生成NH4NO3.25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示).向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将 (填”正向”“不”或“逆向”)移动.

(1)现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
(3)NO2可用氨水吸收生成NH4NO3.25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是
考点:化学平衡状态的判断,反应速率的定量表示方法,盐类水解的原理
专题:
分析:(1)当可逆反应中正逆反应速率相等、反应体系中各物质物质的量不变、浓度不变以及引起的一系列物理量不变时改反应达到平衡状态;
(2)化学平衡常数只与温度有关,温度不变,平衡常数不变;先计算二氧化氮反应速率,再根据同一反应同一时间段内各物质的计量数之比等于其反应速率之比计算四氧化二氮的反应速率;
(3)硝酸铵是强酸弱碱盐,铵根离子水解导致其溶液呈酸性;酸或碱抑制水电离,含有弱离子的盐促进水电离.
(2)化学平衡常数只与温度有关,温度不变,平衡常数不变;先计算二氧化氮反应速率,再根据同一反应同一时间段内各物质的计量数之比等于其反应速率之比计算四氧化二氮的反应速率;
(3)硝酸铵是强酸弱碱盐,铵根离子水解导致其溶液呈酸性;酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答:
解:(1)a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故选ad;
(2)化学平衡常数只与温度有关,温度不变,平衡常数不变;二氧化氮反应速率=
=0.2mol?L-1?s-1,同一反应同一时间段内各物质的计量数之比等于其反应速率之比得四氧化二氮的反应速率=0.1mol?L-1?s-1,故答案为:不变;0.1mol?L-1?s-1;
(3)硝酸铵是强酸弱碱盐,铵根离子水解导致其溶液呈酸性,水解方程式为NH4++H2O?NH3?H2O+H+,向硝酸铵中加入氨水,溶液酸性减弱,酸或碱抑制水电离,含有弱离子的盐促进水电离,所以滴加氨水过程中抑制水电离,则水的电离向逆向移动,故答案为:NH4++H2O?NH3?H2O+H+;逆向.
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故选ad;
(2)化学平衡常数只与温度有关,温度不变,平衡常数不变;二氧化氮反应速率=
| ||
| 3s |
(3)硝酸铵是强酸弱碱盐,铵根离子水解导致其溶液呈酸性,水解方程式为NH4++H2O?NH3?H2O+H+,向硝酸铵中加入氨水,溶液酸性减弱,酸或碱抑制水电离,含有弱离子的盐促进水电离,所以滴加氨水过程中抑制水电离,则水的电离向逆向移动,故答案为:NH4++H2O?NH3?H2O+H+;逆向.
点评:本题考查较综合,涉及反应速率计算、盐类水解、平衡判断等知识点,利用盐类水解特点、平衡状态判断方法、基本公式解答即可,注意只有反应前后改变的物理量才能作为判断平衡状态的依据,为易错点.

练习册系列答案
相关题目
3.72g结晶碳酸钠加热至500℃到质量不再改变为止,冷却称量,质量为3.18g,该种结晶碳酸钠的化学式为( )
| A、Na2CO3?H2O |
| B、Na2CO3?5H2O |
| C、Na2CO3?6H2O |
| D、Na2CO3?10H2O |
下列各物质投入水中,因促进水的电离而使溶液呈酸性的是( )
| A、Na2CO3 |
| B、NaHSO4 |
| C、NH4Cl |
| D、KNO3 |
某温度时,N2+3H2
2NH3的平衡常数K=a,则此温度下,NH3
H2+
N2的平衡常数为( )
| 催化剂 |
| 催化剂 |
| 3 |
| 2 |
| 1 |
| 2 |
| A、a-1/2 | ||
B、
| ||
| C、a1/2 | ||
| D、a-2 |
在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)?N2O4(g)△H<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度.
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度.
| A、①和③ | B、③和⑤ |
| C、④和⑤ | D、②和④ |
“酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
| A、抑制Fe2+的水解,用稀硝酸酸化 |
| B、提高高锰酸钾的氧化能力,用盐酸酸化 |
| C、检验SO42-时,用盐酸酸化 |
| D、检验Cl-时,用稀硫酸酸化 |
在石墨的层状晶体里,每一层由无数个正六边形构成,每个碳原子与层内相邻的三个碳原子C-C键结合,等物质的量的石墨与金刚石中C-C键数之比是( )
| A、2:3 | B、2:1 |
| C、3:4 | D、1:1 |
 W、X、Y、Z四种短周期元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
W、X、Y、Z四种短周期元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: