题目内容
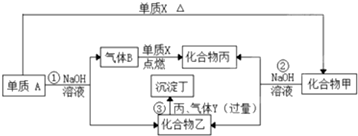
理论与事实相结合,是学习化学的重要方法,现有:FeS+2HCl=FeCl2+H2S↑,CuSO4+H2S=CuS↓+H2SO4,这二个反应在常温下都能进行.通过以上实验,下列结论可能不合理的( )
| A、CuS 不溶于强酸,FeS 可溶于强酸 |
| B、CuS 比FeS的溶解度更小 |
| C、H2S液中电离出的S2-浓度相当大 |
| D、转化成CuS是放热反应 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:由反应可知,FeS可溶于盐酸,而CuS不溶于稀硫酸,说明CuS的溶解度较小,结合反应如能自发进行,应满足△H-T?△S<0解答该题.
解答:
解:A.由反应可知,FeS可溶于盐酸,而CuS不溶于稀硫酸,故A正确;
B.CuS难溶于水,肯定更难溶于水,溶解度比FeS的小,在FeS饱和溶液中加入硫酸铜,可生成CuS沉淀,故B正确;
C.H2S为弱酸,电离程度较小,故C错误;
D.反应CuSO4+H2S=CuS↓+H2SO4中,△S<0,能发生进行,则满足△H-T?△S<0,所以△H<0,为放热反应,故D正确.
故选C.
B.CuS难溶于水,肯定更难溶于水,溶解度比FeS的小,在FeS饱和溶液中加入硫酸铜,可生成CuS沉淀,故B正确;
C.H2S为弱酸,电离程度较小,故C错误;
D.反应CuSO4+H2S=CuS↓+H2SO4中,△S<0,能发生进行,则满足△H-T?△S<0,所以△H<0,为放热反应,故D正确.
故选C.
点评:本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,注意把握反应的特点以及影响难溶电解质的因素,难度不大.

练习册系列答案
相关题目
将1.0mol CO和1.0mol H2O(g)充入某固定容积的反应器中,在一定条件下反应:CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡时有
的CO转化为CO2.在相同条件下,将1.0mol CO和2.0mol H2O(g)充入同一反应器中,在相同温度下达到平衡后,CO2的体积分数约为( )
| 2 |
| 3 |
| A、22.2% |
| B、28.2% |
| C、33.3% |
| D、37.8% |
AgCl和Ag2CrO4的溶度积分别为1.8×10-10 mol2?L-2和2.0×10-12 mol3?L-3,若用难溶盐在溶液中的浓度来表示其溶解度,则下面的叙述中正确的是( )
| A、AgCl和Ag2CrO4的溶解度相等 |
| B、AgCl的溶解度大于Ag2CrO4的溶解度 |
| C、两者类型不同,不能由Ksp的大小直接判断溶解能力的大小 |
| D、都是难溶盐,溶解度无意义 |
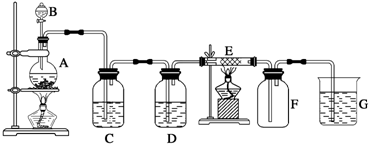
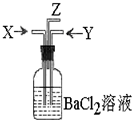 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )| A、洗气瓶中产生的沉淀是碳酸钡 |
| B、Z导管出来的气体中含有二氧化碳 |
| C、气瓶中产生的沉淀是硫酸钡 |
| D、Z导管口有红棕色气体出现 |
下列有关铁及其化合物的说法中正确的是( )
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C、除去FeCl2溶液中的FeCl3杂质,向溶液中加入过量铁粉,过滤 |
| D、FeCl3与KSCN产生红色沉淀 |
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2 固体的量减少,须加入少量的( )
| A、NH4Cl |
| B、NaOH |
| C、MgSO4 |
| D、NaNO3 |