题目内容
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2 固体的量减少,须加入少量的( )
| A、NH4Cl |
| B、NaOH |
| C、MgSO4 |
| D、NaNO3 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:根据平衡移动原理及溶度积解答,要使Mg (OH)2 固体进一步溶解,即平衡向右移动,可以加水,或降低Mg2+或OH-的浓度.
解答:
解:A、加入少量NH4Cl,NH4+与OH-结合生成氨水,故氢氧根的浓度减小,故平衡右移,故A正确;
B、加入NaOH,OH-的浓度增大,平衡向左移动,Mg (OH)2 固体的量增大,故B错误;
C、加入少量Mg2S04,镁离子的浓度增大,平衡左移,Mg (OH)2 固体的量增大,故C错误;
D、加入少量NaNO3,不改变各种物质的浓度,故D错误;
故选A.
B、加入NaOH,OH-的浓度增大,平衡向左移动,Mg (OH)2 固体的量增大,故B错误;
C、加入少量Mg2S04,镁离子的浓度增大,平衡左移,Mg (OH)2 固体的量增大,故C错误;
D、加入少量NaNO3,不改变各种物质的浓度,故D错误;
故选A.
点评:本题考查化学平衡的移动,难度不大,注意D选项硝酸钠为强酸强碱盐不对氢氧化镁中的离子浓度产生影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
理论与事实相结合,是学习化学的重要方法,现有:FeS+2HCl=FeCl2+H2S↑,CuSO4+H2S=CuS↓+H2SO4,这二个反应在常温下都能进行.通过以上实验,下列结论可能不合理的( )
| A、CuS 不溶于强酸,FeS 可溶于强酸 |
| B、CuS 比FeS的溶解度更小 |
| C、H2S液中电离出的S2-浓度相当大 |
| D、转化成CuS是放热反应 |
标准状况下的28L NH3溶于125mL水中,若所得氨水的密度近似为1g?cm-3,则下列说法正确的是( )
A、物质的量浓度(mol?L-1)与溶液质量分数、密度(g?cm-3)的关系为:c=
| ||
| B、此氨水中NH3的物质的量浓度近似为9.9 mol?L-1 | ||
| C、此氨水中NH3的物质的量浓度近似为8.55 mol?L-1 | ||
| D、此氨水中NH3的质量分数为0.17 |
下列说法正确的是( )
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
②物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;
③对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡;
④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全.
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
②物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;
③对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡;
④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全.
| A、①②③④⑤ | B、② |
| C、①③④⑤ | D、①②⑤ |
将氨水滴加到盛有AgCl的试管中,AgCl逐渐溶解,对上述过程,下列叙述或解释中正确的有( )
| A、所得溶液中c(Ag+)×c(Cl-)>Ksp(AgCl) |
| B、所得溶液中形成了更难电离的物质 |
| C、上述实验说明Cl-与NH4+间有很强的结合力 |
| D、上述过程中NH3?H2O的电离程度增大 |
一定温度下,对于反应N2+O2?2NO在密闭容器中进行,下列措施能加快反应速率的是( )
| A、改变温度 |
| B、恒容,充入N2 |
| C、恒容,充入He气 |
| D、恒压,充入He气 |
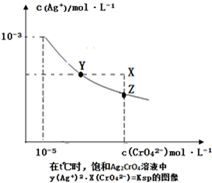 已知t℃时AgCl的Ksp=4×10-l0,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-l0,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A、在t℃时,Ag2CrO4的Ksp为1×10-11 |
| B、在饱和溶液中加入K2CrO4可使溶液由Y点到Z点 |
| C、在t℃时,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107 |
| D、在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
| A、上层为无色,下层为紫红色 |
| B、整个溶液变为棕黄色 |
| C、整个溶液变紫色 |
| D、下层无色,上层紫红色 |