题目内容
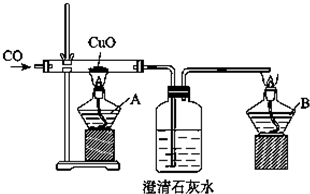
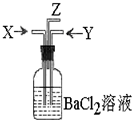 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )| A、洗气瓶中产生的沉淀是碳酸钡 |
| B、Z导管出来的气体中含有二氧化碳 |
| C、气瓶中产生的沉淀是硫酸钡 |
| D、Z导管口有红棕色气体出现 |
考点:实验装置综合,浓硫酸的性质
专题:元素及其化合物
分析:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入时因NO2与水和SO2共同作用要产生SO42-和NO,NO在空气中又会生成NO2,以此解答该题.
解答:
解:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,故洗气瓶中产生的是硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2.
A、H2SO4能与氯化钡反应生成BaSO4,二氧化碳不与氯化钡反应,所以没有BaCO3生成,故A错误;
B、因CO2不与氯化钡反应,从导管中逸出,则Z导管出来的气体中含有二氧化碳,故B正确;
C、因为SO2+H2O+NO2=H2SO4+NO,H2SO4能与氯化钡反应生成BaSO4,所以气瓶中产生的沉淀是硫酸钡,故C正确;
D、反应生成的NO在Z导管口与空气中的氧气反应生成NO2,呈红棕色,故D正确;
故选A.
A、H2SO4能与氯化钡反应生成BaSO4,二氧化碳不与氯化钡反应,所以没有BaCO3生成,故A错误;
B、因CO2不与氯化钡反应,从导管中逸出,则Z导管出来的气体中含有二氧化碳,故B正确;
C、因为SO2+H2O+NO2=H2SO4+NO,H2SO4能与氯化钡反应生成BaSO4,所以气瓶中产生的沉淀是硫酸钡,故C正确;
D、反应生成的NO在Z导管口与空气中的氧气反应生成NO2,呈红棕色,故D正确;
故选A.
点评:本题考查硝酸、浓硫酸的性质以及二氧化硫与二氧化氮等物质的性质题目难度不大,注意相关元素化合物知识的积累.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
下列实验目的可以实现或操作正确的是( )
| A、用托盘天平称取3.23 g NaCl固体 |
| B、称量NaOH固体时,应将砝码放在托盘天平右盘纸片上,NaOH固体放在左盘的纸片上 |
| C、用100 mL容量瓶配制50mL0.1 mol/L的盐酸 |
| D、稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
理论与事实相结合,是学习化学的重要方法,现有:FeS+2HCl=FeCl2+H2S↑,CuSO4+H2S=CuS↓+H2SO4,这二个反应在常温下都能进行.通过以上实验,下列结论可能不合理的( )
| A、CuS 不溶于强酸,FeS 可溶于强酸 |
| B、CuS 比FeS的溶解度更小 |
| C、H2S液中电离出的S2-浓度相当大 |
| D、转化成CuS是放热反应 |
将氨水滴加到盛有AgCl的试管中,AgCl逐渐溶解,对上述过程,下列叙述或解释中正确的有( )
| A、所得溶液中c(Ag+)×c(Cl-)>Ksp(AgCl) |
| B、所得溶液中形成了更难电离的物质 |
| C、上述实验说明Cl-与NH4+间有很强的结合力 |
| D、上述过程中NH3?H2O的电离程度增大 |