题目内容
下列物质的水溶液能导电,但属于非电解质的是( )
| A、HNO3 |
| B、C2H5OH |
| C、NH4NO3 |
| D、SO2 |
考点:电解质与非电解质
专题:
分析:在水溶液里和熔融状态下都不导电的化合物是非电解质,溶液能导电说明含有自由移动的离子.
解答:
解:A.HNO3是强酸,在水溶液里能完全电离出阴阳离子而使溶液导电,所以HNO3是强电解质,故A错误;
B.C2H5OH在水溶液中不能发生电离,是非电解质,不导电,故B错误;
C.NH4NO3在水溶液里能电离出阴阳离子而使其溶液导电,所以NH4NO3是电解质,故C错误;
D.SO2和水反应生成亚硫酸,亚硫酸能电离出阴阳离子而使其溶液导电,二氧化碳不能发生电离,是非电解质,故D正确;
故选D.
B.C2H5OH在水溶液中不能发生电离,是非电解质,不导电,故B错误;
C.NH4NO3在水溶液里能电离出阴阳离子而使其溶液导电,所以NH4NO3是电解质,故C错误;
D.SO2和水反应生成亚硫酸,亚硫酸能电离出阴阳离子而使其溶液导电,二氧化碳不能发生电离,是非电解质,故D正确;
故选D.
点评:本题主要考查了电解质和非电解质、溶液导电性的原因,关键注意非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子,题目难度不大.

练习册系列答案
相关题目
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)=4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑.下列有关说法不正确的是( )
| A、电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-=Na |
| B、盖?吕萨克法制钠原理是利用铁的还原性比钠强 |
| C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:2 |
D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
想一想,如果将Ba(OH)2(固体)、CuSO4(固体)、纯醋酸(液态)归为一类,下列物质还可以和它们归为一类的是( )
| A、硝酸钠晶体 |
| B、豆浆 |
| C、Fe (OH)3胶体 |
| D、75%的酒精溶液 |
下列各组离子因为生成难溶物而不能大量共存的是( )
| A、Cl-、Fe3+、NO3-、OH- |
| B、HCO3-、Cl-、Na+、H+ |
| C、Ba2+、Cl-、NO3-、K+ |
| D、NH4+、K+、OH-、Cl- |
下列关于有机物的说法中,正确的是( )
A、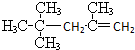 的名称为2,2,4-三甲基戊烯 的名称为2,2,4-三甲基戊烯 |
B、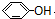 、 、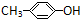 和 和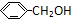 互为同系物 互为同系物 |
| C、CH≡CCH2CH3的所有碳原子在一条直线上 |
D、HCHO和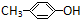 在一定条件下能发生缩聚反应生成 在一定条件下能发生缩聚反应生成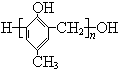 |