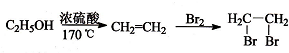题目内容
14.用惰性电极电解物质的量浓度相同、体积比为1:3的CuSO4和NaCl的混合溶液,可能发生的反应有( )①2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;
②Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑;
③2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
④2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
分析 用惰性电极电解物质的量浓度相同、体积之比为1:3的CuSO4和NaCl的混合溶液,设溶液体积为1L,硫酸铜浓度为1mol/L,氯化钠浓度为3mol/L,则n(CuSO4)=n(Cu2+)=1mol,n(NaCl)=n(Cl-)=3mol,
根据转移电子守恒,
第一阶段,阳极上Cl-放电、阴极上Cu2+放电,当Cu2+完全放电时,有2mol Cl-放电;
第二阶段:阳极上Cl-放电,阴极上水得电子生成氢气;
第三阶段:阳极上OH-放电,阴极上H+放电,相当于对水,
据此分析解答.
解答 解:用惰性电极电解物质的量浓度相同、体积之比为1:3的CuSO4和NaCl的混合溶液,设溶液体积为1L,硫酸铜浓度为1mol/L,氯化钠浓度为3mol/L,则n(CuSO4)=n(Cu2+)=1mol,n(NaCl)=n(Cl-)=3mol,
根据转移电子守恒,
第一阶段,阳极上Cl-放电、阴极上Cu2+放电,当Cu2+完全放电时,有2mol Cl-放电,相当于电解氯化铜,电池反应式为Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑;
第二阶段:阳极上Cl-放电,阴极上水得电子生成氢气,电池反应式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
第三阶段:阳极上OH-放电,阴极上H+放电,相当于对水,电池反应式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的反应及反应的各个阶段是解本题关键,题目难度不大.

练习册系列答案
相关题目
2.将标准状况下V mL CO2缓慢通入200mL 0.15mol/L的NaOH溶液中,气体被充分吸收,下列关系不正确的是( )
| A. | V=336 mL时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| B. | V=448 mL时,2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | |
| C. | V=672 mL时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) | |
| D. | 通入CO2过程中恒有关系式:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
9.有机物CH2=CH-CH2-CH2Cl能发生的反应有( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦加聚反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦加聚反应.
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
19.乙醇、乙二醇、丙三醇中分别加入足量金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
| A. | 3:2:1 | B. | 1:1:1 | C. | 1:2:3 | D. | 6:3:2 |
4.日本福岛第一核电站发生严重的核辐射泄漏,日本政府向福岛核电站附近居民发放碘片(12753I),以降低放射性碘对人体的伤害.已知核辐射中放射性碘(碘13153I)的核电荷数为53,则下列说法正确的是( )
| A. | 核裂变是一种化学变化 | |
| B. | 12753I的质量数为127,原子序数为53,核内有74个中子 | |
| C. | 碘12753I和放射性碘13153I属于同素异形体 | |
| D. | 12753I与13153I是同一种核素 |
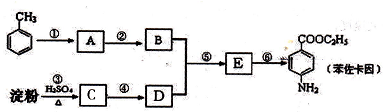
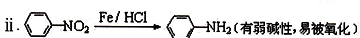
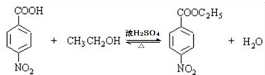 .
.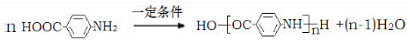
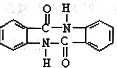 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图: