题目内容
13.某实验小组设计了如下装量对焦炭还原二氧化硅的气体产物的成分进行探究.
已知:PdCl2溶液可用于检验CO,反应的化学方程式为:CO+PdCl2+H2O═CO2+2HC1+Pd↓(产生黑色金属钯粉末,使溶液变浑浊).
(1)实验时要通人足够长时间的N2,其原因是要用氮气将装置中的空气排尽.
(2)装置B的作用是作安全瓶,防止倒吸.
(3)装置C、D中所盛试剂分别为澄清石灰水、PdCl2溶液,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为3SiO2+4C$\frac{\underline{\;高温\;}}{\;}$2CO2+2CO+3Si.
(4)该装置的缺点是没有尾气吸收装置将CO吸收.
分析 (1)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽;
(2)根据装置图可知,B装置可以作安全瓶,防止倒吸;
(3)根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳;若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,检测两气体产物的物质的量相等,根据元素守恒可写出化学方程式;
(4)一氧化碳有毒,有能排放到空气中,而该装置没有尾气吸收装置;
解答 解:(1)碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽,所以实验时要通人足够长时间的N2,
故答案为:要用氮气将装置中的空气排尽;
(2)根据装置图可知,B装置可以作安全瓶,防止倒吸,
故答案为:作安全瓶,防止倒吸;
(3)根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳,所以置C、D中所盛试剂分别为澄清石灰水、PdCl2溶液;若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,检测两气体产物的物质的量相等,根据元素守恒可知化学方程式为3SiO2+4C$\frac{\underline{\;高温\;}}{\;}$2CO2+2CO+3Si,
故答案为:澄清石灰水、PdCl2溶液;3SiO2+4C$\frac{\underline{\;高温\;}}{\;}$2CO2+2CO+3Si;
(4)一氧化碳有毒,有能排放到空气中,而该装置没有尾气吸收装置将CO吸收,
故答案为:没有尾气吸收装置将CO吸收.
点评 本题考查了物质组成的实验探究方法,过程分析判断,实验设计,注意题干信息的分析判断应用,掌握基础是关键,题目难度中等.


| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | Fe2++Br2═Fe3++Br- |
| A. | 0.01mol•L-1HA的溶液中c(H+)=1×10-4 mol•L-1 | |
| B. | PH=3的HA溶液与PH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-) | |
| D. | PH=3的HA溶液与PH=11的NaOH溶液按体积比1:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+) |
 安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究:
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究: +H2O2
+H2O2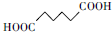 +H2O
+H2O
